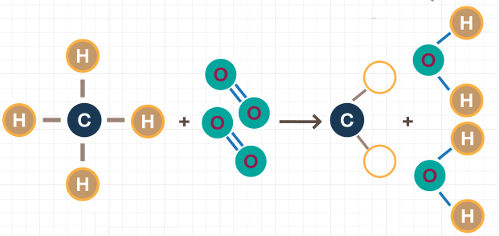
A energia de ligação está envolvida na quebra ou na formação de uma ou mais ligações entre átomos de uma molécula. A molécula de gás hidrogênio, por exemplo, apresenta uma ligação simples (sigma) entre os átomos envolvidos:
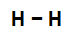
Fórmula estrutural do gás hidrogênio
Para essa molécula ter sido originada, a ligação simples entre seus átomos foi formada. Já quando essa molécula participa de uma reação química com o gás cloro (Cl2), por exemplo, para formação do ácido clorídrico (HCl), as ligações simples presentes no H2 e no Cl2 devem ser quebradas com a consequente formação de uma ligação simples no HCl.
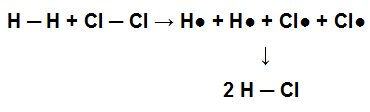
Representação da quebra de ligações simples no reagente e formação de uma ligação simples no produto
Os átomos estabelecem ligações entre si para atingir sua estabilidade eletrônica, isto é, eles saem de uma situação de maior energia para outra de menor energia. Com isso, podemos afirmar que, quando a ligação entre átomos é formada, ocorre liberação de energia; portanto, consequentemente, a sua quebra depende de absorção de energia.
Se entendemos que o rompimento (quebra) de uma ligação química ocorre quando é fornecida a ela uma quantidade de energia (xKcal), concluímos que se trata de um processo endotérmico. Em contrapartida, a formação de uma ligação envolverá a liberação da mesma quantidade de energia (-xkcal), sendo, então, um processo exotérmico.
Como as reações químicas são classificadas em endotérmicas ou exotérmicas, podemos utilizar o conhecimento das energias de ligação das moléculas dos reagentes e dos produtos para determinar a variação da energia (ΔH) do processo químico e, em seguida, classificá-lo.
Por exemplo, veja a equação abaixo:
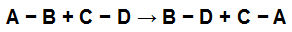
Ligações químicas nos participantes de uma equação química
Temos ligações simples em cada um dos participantes da reação. Elas apresentam os seguintes valores:
-
[A-B] = 50 Kcal
-
[C-D] = 100 Kcal
-
[B-D] = 80 Kcal
Não pare agora... Tem mais depois da publicidade ;) -
[A-C] = 230 Kcal
Com os valores acima, podemos calcular a energia envolvida na quebra das ligações dos reagentes e na formação das ligações dos produtos da seguinte maneira:
-
Nos reagentes
50 Kcal para romper a ligação AB e 100 Kcal para romper a ligação CD, ou seja, no reagente, serão utilizados 150 Kcal para o rompimento das ligações.
-
Nos produtos
80 Kcal para formar a ligação BD e 230 Kcal para formar a ligação AC, ou seja, no produto serão liberados 310 Kcal na formação das ligações
Com os valores das energias envolvidas nos reagentes e produtos, é possível saber se a reação absorveu ou liberou mais energia apenas subtraindo a energia utilizada no rompimento pela energia liberada na formação:
ΔH = Energia dos reagentes – Energia dos produtos
ΔH = 230 – 310
ΔH = -80 Kcal
Como a reação tem mais liberação de energia do que absorção, ΔH negativo, logo, é exotérmica.
OBS.: Caso o coeficiente estequiométrico do participante seja diferente de 1, devemos multiplicar o valor da energia da ligação pelo coeficiente, por exemplo:
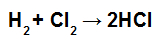
Equação de formação do HCl
Como o coeficiente do HCl é 2, devemos multiplicar o valor da ligação do HCl por 2.
Acompanhe agora a resolução de um exercício sobre energia de ligação em uma reação química:
Exemplo: Dadas as seguintes energias de ligação, em quilojoules por mol de ligações (valores absolutos):
H− H = 436
N ≡ N = 945,6
N− H = 391
Calcule o calor (em quilojoules por mol de NH3(g)) envolvido na reação representada por:
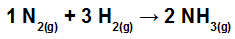
Ligações químicas na reação de formação do NH3
Resolução:
O primeiro passo para realizar a resolução desse exercício é reescrever a equação fornecida demonstrando as ligações químicas presentes em cada uma das moléculas:
-
No N2: temos uma ligação tripla (porque o N, família do Nitrogênio, deve realizar três ligações por ter cinco elétrons na camada de valência);
Não pare agora... Tem mais depois da publicidade ;) -
No H2: Temos uma ligação simples (porque o H deve realizar apenas uma ligação por ter apenas um elétron na camada de valência);
-
No NH3: Temos a presença de três ligações simples (porque cada H necessita de uma ligação, e o N, de três ligações).
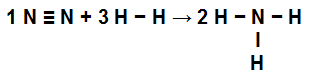
Equação demonstrando as ligações na formação do NH3
Como o exercício forneceu os valores de cada ligação, o primeiro passo é determinar a energia de ligação relacionada com cada um dos participantes:
- Para o N2
Temos 1 mol de N2 na equação e, para romper sua ligação, necessitamos de 945,4 KJ, logo:
1.945,4 = 945,4 KJ
- Para o H2
Temos 3 mol de H2 na equação e, para romper sua ligação, necessitamos de 436 KJ, logo:
3.346 = 1038 KJ
- Para o NH3
Temos 2 mol de NH3 na equação, mas há três vezes a ligação N-H, por isso, vamos multiplicar o valor da energia envolvida para formar essa ligação por 2 e por 3:
2.3.391 = 2346 KJ
Por fim, podemos determinar o calor envolvido na reação subtraindo a energia usada para rompimento do reagente pela energia liberada na formação do produto:
ΔH = energia nos reagentes – energia nos produtos
ΔH = (945,4 + 1038) - 2346
ΔH = 1983,4 – 2346
ΔH = - 362,6 KJ por mol de NH3(g)
Como a variação foi negativa, significa que a energia liberada na formação das ligações nos produtos foi maior que a energia absorvida na quebra das ligações dos reagentes, por isso, a reação é exotérmica.
Por Me. Diogo Lopes Dias