“Ligação química” foi um termo usado pela primeira vez por Gilbert Newton Lewis no ano de 1920 em um artigo para explicar por que os átomos se mantêm unidos para formar as substâncias e também por que eles permanecem unidos ao longo de milhares de anos.
Os átomos da maioria dos elementos químicos até então conhecidos e enunciados na Tabela Periódica não aparecem na forma isolada na natureza. A maioria dos materiais presentes em nosso cotidiano são substâncias que podem ser simples (constituídas de átomos de somente um tipo de elemento químico) ou compostas (possuem átomos de dois ou mais elementos químicos diferentes).
Isso ocorre porque os átomos têm a capacidade de realizar ligações químicas com outros átomos, que podem ser do mesmo elemento ou de elementos diferentes. Essas ligações são tão fortes que se não sofrer nenhuma influência externa, na maioria dos casos, os átomos permanecerão unidos como estão.
Tópicos deste artigo
Mapa Mental: Ligações Químicas
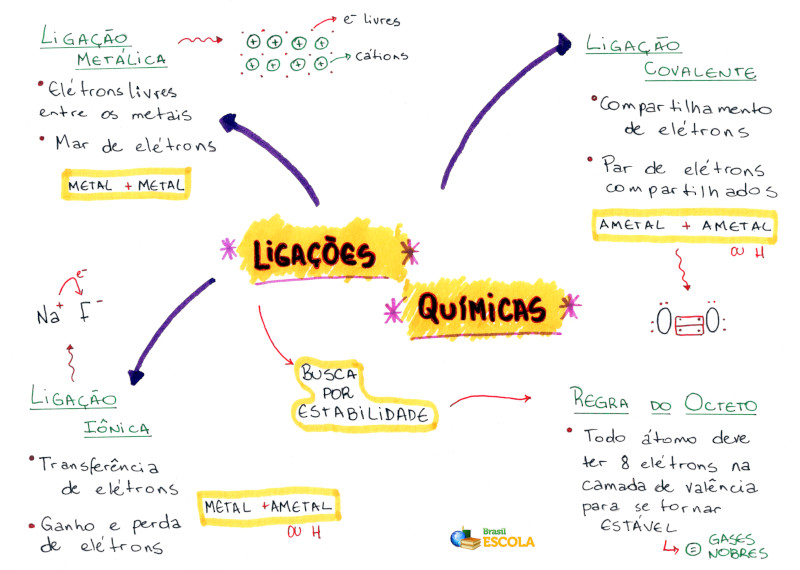
*Baixe o mapa mental sobre ligações químicas!
Por exemplo, não é comum encontrarmos um átomo de oxigênio livre na natureza; entretanto, encontramos várias substâncias em que ele aparece ligado a outros átomos. Um exemplo de substância simples é o gás oxigênio em que cada molécula é formada por dois átomos de oxigênios ligados (O2); enquanto um exemplo de substância composta é a água, onde cada molécula possui dois átomos de hidrogênios ligados a um átomo de oxigênio (H2O).
Os únicos elementos que são encontrados isolados na natureza de forma estável são os gases nobres, isto é, os elementos da família 18 da Tabela Periódica (He, Ne, Ar, Kr, Xe e Rn). Todos esses elementos têm em comum o fato de terem oito elétrons na última camada eletrônica (camada de valência), com exceção do hélio (He), que possui apenas uma camada eletrônica (camada K) e, portanto, detém dois elétrons, que é a quantidade máxima possível de elétrons nessa camada.
Assim, Gilbert N. Lewis e também o cientista Water Kossel chegaram à conclusão de que os átomos dos outros elementos ligam-se para ficarem com oito elétrons (ou dois, no caso de possuir somente a camada K) e, dessa forma, estabilizarem-se. Criou-se, então, a teoria eletrônica da valência, que indica quantas ligações químicas o átomo de um elemento realiza, tendo como base a ideia explicada.
Sendo assim, os átomos realizam ligações químicas, procurando perder, ganhar ou compartilhar elétrons da camada de valência até atingirem a configuração do próximo gás nobre. Essa teoria passou também a ser chamada de regra do octeto.
Por exemplo, o oxigênio é bivalente, porque ele possui seis elétrons na sua camada de valência. Por isso, ele precisa receber mais dois elétrons para ficar com configuração do gás nobre neônio (Ne), isto é, com oito elétrons na camada de valência, que nesse caso é a camada L. No caso do gás oxigênio e da água mencionados, temos o seguinte:
.jpg)
Moléculas de oxigênio e de água formadas por ligações covalentes
Observe que, no primeiro caso (gás oxigênio - O2), cada átomo de oxigênio compartilha dois elétrons, sendo que ambos ficam com oito elétrons na camada de valência. Isso significa que é realizada uma ligação dupla (duas ligações ao mesmo tempo entre dois átomos).
Já no caso da água, cada um dos dois átomos de hidrogênio compartilha um elétron com o átomo central de oxigênio e todos ficam estáveis (o oxigênio fica com oito elétrons na camada de valência e cada hidrogênio fica com dois elétrons). Aqui também são realizadas duas ligações simples.
Esse tipo de ligação química, em que todos os átomos precisam receber elétrons (hidrogênio, ametais e semimetais) e em que há o compartilhamento de elétrons em pares, é chamado de ligação covalente.
Mas existem mais dois tipos de ligações químicas:
(1) Ligação iônica → há a transferência definitiva de elétrons de um átomo para outro. Esse tipo de ligação ocorre entre átomos de metais (que têm a tendência de perder elétrons para ficarem estáveis) e átomos de hidrogênio, ametais e semimetais (que têm a tendência de ganhar elétrons para ficarem estáveis).
Um exemplo é o cloreto de sódio (NaCl - sal de cozinha) em que o sódio é um metal que tem a tendência de perder um elétron, enquanto o cloro é um ametal que tem a tendência de ganhar um elétron. Dessa forma, o sódio doa (seta vermelha) um elétron para o cloro, formando o sal, uma substância muito estável. Visto que se formam (seta preta) íons, que são espécies químicas com cargas opostas (+ e -), um íon atrai outro próximo e são formados aglomerados iônicos com um número enorme de íons, como são os cristais do sal de cozinha.
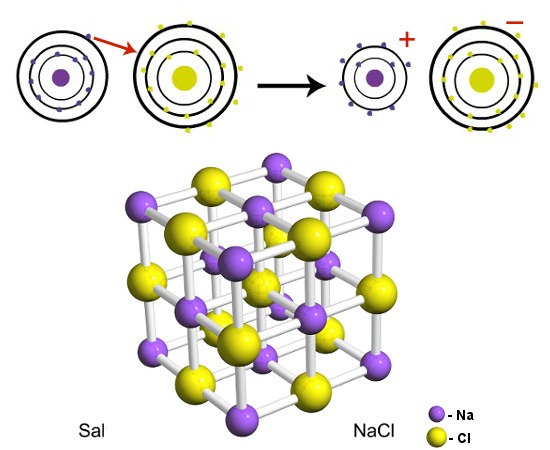
Formação de cloreto de sódio por meio de ligação iônica
(2) Ligação metálica → É uma teoria que diz que os metais (tais como alumínio, ouro, prata, cobre etc.) são formados por um aglomerado de átomos nêutrons e cátions que se mantêm unidos por uma espécie de “nuvem” de elétrons livres (elétrons que foram perdidos na formação dos cátions citados). Essa nuvem (ou mar) de elétrons funcionaria como uma ligação metálica que manteria os átomos unidos.
Para mais detalhes sobre esses tipos de ligações químicas, bem como a regra do octeto, leia os artigos relacionados mais abaixo.
Mapa mental Por M.e Victor Ricardo Ferrreira
Professor de Química
Por Jennifer Fogaça
Graduada em Química

