O elemento químico fósforo (P) pertence ao terceiro período da Tabela Periódica e à família do Nitrogênio (VA). Por essa razão, seus átomos realizam normalmente três ligações químicas para atingir a teoria do octeto (estabilidade). Porém, existem algumas situações em que um átomo de fósforo realiza mais de três ligações, fato que somente é possível por meio do fenômeno da hibridização.
Para entender a hibridização do fósforo, devemos entender primeiro por que o átomo desse elemento realiza três ligações. Para isso, basta acompanharmos a sua distribuição eletrônica:

Distribuição eletrônica do Fósforo
Podemos observar que, na camada de valência, o átomo de fósforo apresenta o subnível 3s completo (com dois elétrons) e o subnível 3p incompleto (cada um dos três orbitais do subnível p apresenta um elétron). A seguir temos a distribuição dos elétrons nos orbitais dos subníveis da camada de valência do Fósforo:
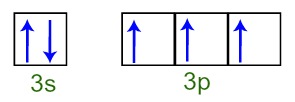
Representação dos elétrons da camada de valência do átomo de Fósforo
Como cada um dos orbitais do subnível 3p está incompleto, o átomo de fósforo consegue realizar três ligações químicas, atingindo, assim, a estabilidade.
Agora, quando analisamos a substância PCl5, por exemplo, temos a certeza de que, nessa molécula, o fósforo sofreu hibridização, pois realizou cinco ligações. Como o cloro, que pertence à família VIIA, necessita de uma ligação para ficar estável e a molécula possui cinco átomos desse elemento, cada um deles deverá realizar uma ligação, o que faz com que o átomo de fósforo, por sua vez, também tenha que realizar cinco ligações. Essa ocorrência só é possível por meio da hibridização (união de orbitais atômicos incompletos) do fósforo.
Ao receberem energia do meio externo, os elétrons do átomo de Fósforo excitam-se. Logo em seguida, um dos dois elétrons pertencentes ao subnível 3s desloca-se para um orbital vazio presente no subnível d, que até então não possui nenhum elétron. Veja o esquema a seguir:

Ao receberem energia, os elétrons do fósforo excitam-se e um ocupa um orbital do subnível d
Nesse momento, temos na camada de valência do Fósforo um orbital s, três orbitais p e um orbital d incompleto. Por fim, esses cinco orbitais hibridizam-se, ou seja, unem-se, resultando então em cinco orbitais atômicos incompletos, que são capazes agora de realizar cinco ligações químicas.
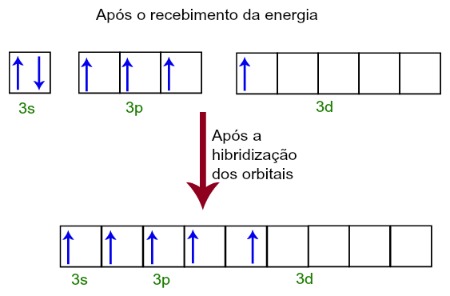
Hibridização dos orbitais atômicos incompletos do fósforo
Como foram unidos um orbital s, três orbitais p e um orbital d, a hibridização do Fósforo é do tipo sp3d.
Por Me. Diogo Lopes Dias
