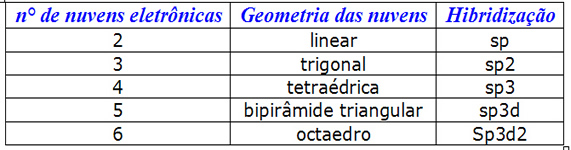
A Teoria da Hibridização explica a presença de ligações covalentes em muitos elementos químicos.
A partir do número de nuvens eletrônicas ao redor de um átomo, torna-se possível definir sua hibridização.
Não pare agora... Tem mais depois da publicidade ;)
Vamos a alguns exemplos:
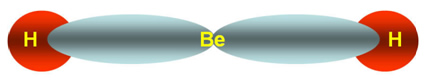
2 nuvens ao redor do berílio
Hibridização sp
Neste caso, o átomo central na geometria linear é Be, contendo 2 nuvens eletrônicas representadas na cor cinza.
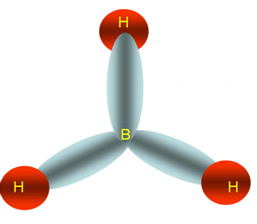
3 nuvens ao redor do boro
Hibridização sp2
O composto acima possui geometria trigonal.
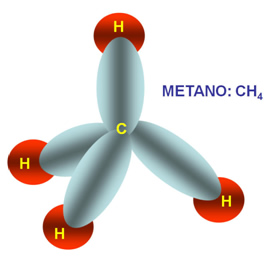
4 nuvens ao redor do carbono
Hibridização sp3
Não pare agora... Tem mais depois da publicidade ;)
O metano representa perfeitamente a geometria tetraédrica.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola



