A constante de hidrólise (Kh) refere-se a um equilíbrio químico estabelecido a partir da hidrólise de um sal (reação química que envolve um sal solúvel e a água).
Como a constante de qualquer outro equilíbrio, a expressão da constante de hidrólise é construída a partir do produto das concentrações dos produtos dividido pelo produto das concentrações dos reagentes, da seguinte forma:
Kh = [produtos]
[reagentes]
O trabalho com a constante de hidrólise envolve o conhecimento de três importantes fenômenos:
Tópicos deste artigo
- 1 - Dissociação dos sais
- 2 - Ionização da água
- 3 - Hidrólise de um sal
- 4 - Construção da expressão da constante de hidrólise
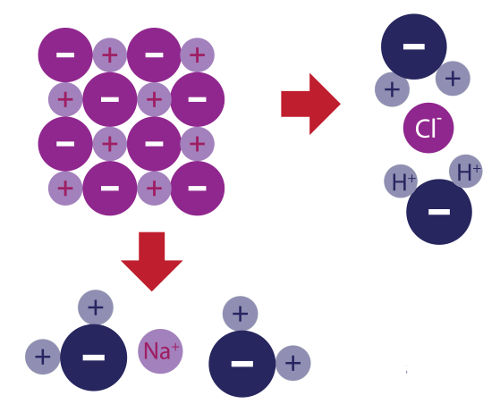
Dissociação dos sais
Quando um sal solúvel é adicionado à água, ele se dissocia e libera cátion diferente do hidrônio (H+) e ânion diferente da hidroxila (OH-).
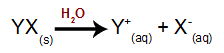
Para relembrar quando um sal é solúvel ou não em água, estude a tabela de solubilidade dos sais.
Ionização da água
A água é uma substância que naturalmente sofre o fenômeno da autoionização, ou seja, produz um cátion hidrônio e um ânion hidroxila.
![]()
Equação de ionização da água
Hidrólise de um sal
Como um sal solúvel libera íons na água e esta sofre ionização, produzindo íons no meio, pode ocorrer a reação (hidrólise) entre os íons do sal e os íons da água. Quando essa reação ocorre, as possíveis interações são:
- Cátion do sal com o ânion da água (formação de uma base);
- Ânion do sal com o cátion da água (formação de um sal);
As interações acima ocorrerão apenas se a base ou o ácido formado for fraco.
Veja um exemplo da hidrólise de um sal:
→ Hidrólise do hipoclorito de amônio (NH4ClO)
Quando o hipoclorito de amônio é adicionado à água, dissolve-se e dissocia-se, liberando os íons cátion amônio (NH4+) e o ânion hipoclorito (ClO-):
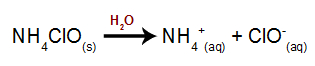
Equação que mostra os íons liberados na dissociação do hipoclorito de amônio
Como a água, ao sofrer ionização, produz H+ e OH-, temos na solução dois cátions e dois ânions, os quais podem reagir. O cátion NH4+ só reage com o ânion OH- porque forma uma base fraca (NH4OH). O ânion ClO- só reage com o cátion H+ porque forma um ácido fraco (HClO).
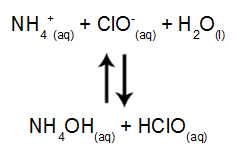
Equação do equilíbrio de hidrólise do hipoclorito de amônio
Construção da expressão da constante de hidrólise
A construção da constante de hidrólise de um sal depende exclusivamente da equação de hidrólise desse sal. A hidrólise do hipoclorito de amônio, por exemplo, trabalhada no item anterior, gerou a seguinte equação:
.jpg)
Equação do equilíbrio de hidrólise do hipoclorito de amônio
Como a construção da expressão da constante de hidrólise leva em conta produtos e reagentes, a expressão da constante seria:
Kh = [HClO].[NH4OH]
[ClO-].[NH4+]
OBS.: A água não participa da equação por ser um reagente líquido e também por ser o meio fundamental para a ocorrência da hidrólise, ou seja, ela é constante.
Por Me. Diogo Lopes Dias