Kp é a sigla utilizada para determinar a constante de um equilíbrio em termos de pressões parciais. Essa constante trabalha com os valores dos participantes gasosos de um equilíbrio na unidade atm, por exemplo.
![]()
Equação que representa uma reação química com componentes gasosos
Nessa equação, todos os participantes são gasosos, dessa forma, quando um gás participante apresenta uma pressão parcial na mistura, ela é representada pela sigla pX.
Ao montarmos a equação do equilíbrio químico (em termos de concentração), os produtos devem ser posicionados no numerador e os reagentes são posicionados no denominador:
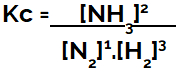
Expressão do Kc do equilíbrio de formação da amônia
A expressão da constante de equilíbrio em termos de pressão (Kp) segue o padrão do Kc, ou seja, as pressões parciais dos reagentes ficam posicionadas no denominador e as pressões parciais dos produtos no numerador:
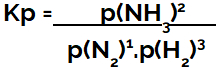
Expressão do Kp do equilíbrio de formação da amônia
Observação: Caso a equação da reação do equilíbrio químico não apresente nenhum participante gasoso, automaticamente não apresentará Kp.
Exemplo: (PUC-MG) Para a reação: 2 CO(g) + O2(g)? 2 CO2(g), as pressões parciais de CO(g) e O2(g) no equilíbrio são, respectivamente, 0,2 atm e 0,4 atm. A pressão total do sistema é de 1,4 atm. O valor de Kp para a reação é:
a) 56,2
b) 40,0
c) 35,6
d) 28,4
e) 25,6
Os dados fornecidos pelo exercício são:
-
Pressão parcial do monóxido de carbono (pCO) = 0,2 atm;
-
Pressão parcial do monóxido de carbono (pO2) = 0,4 atm;
-
Pressão total =1,4 atm;
Para determinar o Kp desse sistema, devemos realizar os seguintes passos:
-
1º Passo: Determinar a pressão parcial do monóxido de carbono (pCO2).
Para isso, basta lembrar que a pressão total (pt) é a soma de todas as pressões parciais:
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p(CO2) + 0,4
1,4 – 0,2 – 0,4 = pCO2
pCO2 = 0,8 atm
-
2º Passo: Determinar o Kp do exercício.
Para isso, basta utilizar os valores na expressão da constante do equilíbrio Kp:
Kp = (pCO2)2
(pCO)2.(pO2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
Por Me. Diogo Lopes Dias
