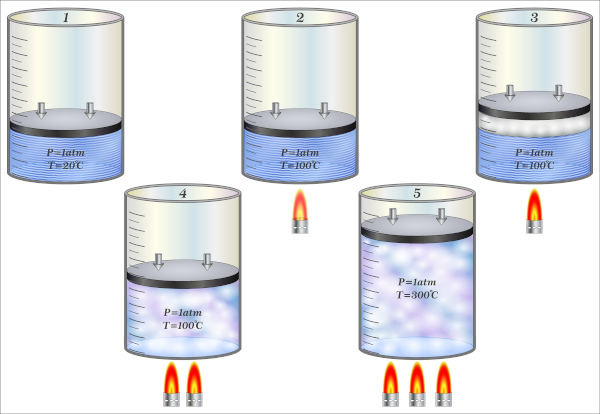
A transformação isobárica é um processo termodinâmico que consiste na conservação da pressão ainda que seja variado o volume ou a pressão do gás. Ela foi desenvolvida pelo Jacques Charles e evidenciada pelo Joseph Gay-Lussac. Nela, o volume inicial dividido pela temperatura inicial é igual ao volume final dividido pela temperatura final.
Leia também: Gás ideal — o modelo de gás em que as colisões entre as partículas são perfeitamente elásticas
Tópicos deste artigo
- 1 - Resumo sobre transformação isobárica
- 2 - Videoaula sobre transformação isobárica
- 3 - O que é transformação isobárica?
- 4 - Como ocorre a transformação isobárica?
- 5 - Fórmulas da transformação isobárica
- 6 - Gráficos da transformação isobárica
- 7 - Exercícios resolvidos sobre transformação isobárica
Resumo sobre transformação isobárica
-
A nomenclatura isobárica significa “pressão igual”.
-
A transformação isobárica acontece quando o gás apresenta pressão constante estando em um sistema fechado.
-
Na expansão isobárica, temos um crescimento de volume, temperatura e energia interna do gás.
-
Na compressão isobárica, temos um decréscimo de volume, temperatura e energia interna do gás.
-
O trabalho de um gás na transformação isobárica é dado pelo produto entre a pressão e a variação de volume.
Não pare agora... Tem mais depois da publicidade ;) -
Na transformação isobária, temos um gráfico para o volume relacionado à tempeatura e outro gráfico para a pressão relacionada ao volume.
-
No gráfico que relaciona o volume à tempeatura, a pressão é representada por uma reta inclinada crescente ou descrescente.
-
No gráfico que relaciona a pressão ao volume, a pressão é representada por uma reta constante.
Videoaula sobre transformação isobárica
O que é transformação isobárica?
A transformação isobárica, também chamada de lei de Charles e Gay-Lussac, é uma transformação termodinâmica em que há preservação da pressão, independentemente da modifição do volume ou da temperatura do gás.
Ela foi formulada pelo cientista Jacques Charles (1746-1823), comprovada experimentalmente pelo físico-químico Joseph Gay-Lussac (1778-1850) e pode ser enunciada como:
Quando a pressão de uma amostra de gás permanece constante, a sua temperatura é diretamente proporcional ao seu volume.|1|
Não pare agora... Tem mais depois da publicidade ;)
Sua nomenclatura advém do grego, iso, que significa “igual”, e baros, que significa “pressão”, por isso, isobárica significa “pressão igual, constante”.
→ Exemplos de transformação isobárica
A transformação isobárica é encontrada sempre que a pressão for constante, por exemplo, uma bexiga cheia de ar tem seu volume alterado na medida em que varia a temperatura do gás em seu interior, contudo, a sua pressão externa se mantém inalterada, da mesma forma ocorre com os balões de ar quente.
Como ocorre a transformação isobárica?
A transformação isobárica ocorre quando um gás está sob pressão constante em um sistema fechado, no qual existem trocas de energia com a vizinhança e se modifica o volume e a temperatura desse gás.
Na transformação isobárica, podemos ter a expansão isobárica, em que há ampliação do volume e da temperatura do gás e, consequentemente, o aumento da energia interna e a compressão isobárica, em que se tem a diminuição de volume e da temperatura do gás, portanto, a redução da energia interna.
Fórmulas da transformação isobárica
→ Relação entre pressão, volume e temperatura
\(\frac{p_o\cdot V_o}{T_o}=\frac{p\cdot V}T\)
-
\(p_o\) → pressão inicial, medida em Pascal \(\).
Não pare agora... Tem mais depois da publicidade ;) -
\(v_o\) → volume inicial, medido em metros cúbicos \([m^3]\) ou litros \(\).
-
\(T_o\) → temperatura inicial, medida em Kelvin \(\).
-
p → pressão final, medida em Pascal \(\).
-
V → volume final, medido em metros cúbicos \([m^3]\) ou litros \(\).
-
T → temperatura final, medida em Kelvin \(\).
→ Transformação isobárica
\(\frac{V_o}{T_o}=\frac{ V}T\)
-
\(V_o\) → volume inicial, medido em metros cúbicos \([m^3]\) ou litros \(\).
-
\(T_o\) → temperatura inicial, medida em Kelvin \(\).
-
V → volume final, medido em metros cúbicos \([m^3]\) ou litros \(\).
-
T → temperatura final, medida em Kelvin \(\).
Exemplo:
Um gás com volume de 10 l, temperatura de 200 K e pressão de 4 atm sofre uma variação de temperatura, alterando-se para 10 K. Em vista disso, qual volume o gás passa a ocupar?
Resolução:
Calcularemos o volume do gás por meio da fórmula que relaciona a pressão, o volume e a temperatura.
\(\frac{p_o\cdot V_o}{T_o}=\frac{p\cdot V}T\)
Como a pressão é constante, podemos eliminá-la, resultando na fórmula da transformação isobárica:
\(\frac{V_o}{T_o}=\frac{V}T\)
Neste exercício, não há necessidade de converter as unidades de medida:
\(\frac{10}{200}=\frac{V}{10}\)
\(10\cdot10=200\cdot V\)
\(100=200\cdot V\)
\(V=\frac{100}{200}\)
\(V=0,5\ l\)
O volume passou a ser de 0,5 l ou 500 ml.
→ Trabalho de um gás em uma transformação isobárica
\(W=p\cdot ∆V\)
Também pode ser representado por:
\(W=p\cdot(V-V_o)\)
-
W → trabalho do gás, medido em Joule \(\).
-
p → pressão, medida em Pascal \(Pa\).
-
\(∆V\) → variação de volume, medida em metros cúbicos \([m^3]\) ou litros \(\).
Não pare agora... Tem mais depois da publicidade ;) -
\(V_o\) → volume inicial, medido em metros cúbicos \([m^3]\) ou litros \(\).
-
V → volume final, medido em metros cúbicos \([m^3]\) ou litros \(\).
Exemplo:
Qual o trabalho de um gás que manteve sua pressão de 20.000 Pa quando variou seu volume de \(50\ m^3\) para \(60\ m^3\)?
Resolução:
Calcularemos o trabalho por meio da fórmula do trabalho do gás em uma transformação isobárica:
\(W=p\cdot∆V\)
\(W=p\cdot(V-V_o)\)
\(W=20.000 \cdot(60-50)\)
\(W=20.000 \cdot(10)\)
\(W=200.000 \)
\(W=2 \cdot10^5 \ J \)
O trabalho do gás foi de \(2 \cdot10^5\) Joules.
Importante: Na maioria dos exercícios, é necessário a conversão das unidades de medida da pressão, do volume e da temperatura. Na pressão, basta multiplicarmos o valor dado em atm por \(1,01\cdot10^5 \ Pa\); por exemplo, 5 atm são \(5,05\cdot10^5\ Pa\). Na temperatura, somamos 273 ao valor dado em Celsius, por exemplo, 100 °C é 373 K. Já no volume, dividimos o valor dado em litros por mil, já que 1 l é 0,001 \(m^3\).
Veja também: Transformação isocórica (isovolumétrica) — quando o gás apresenta volume constante em um sistema fechado
Gráficos da transformação isobárica
Na transformação isobárica, é possível obter dois gráficos, um que relaciona o volume à temperatura e outro que relaciona a pressão ao volume.
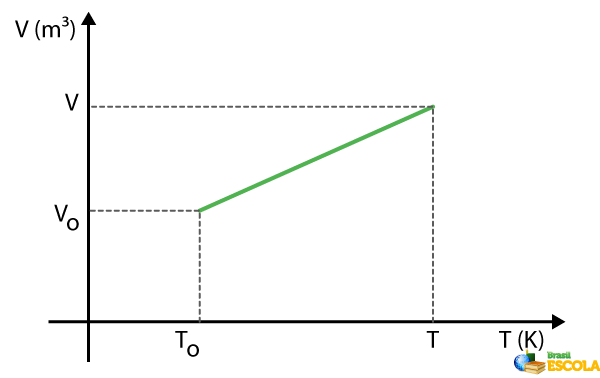
→ Gráfico da transformação isobárica V x T
No gráfico do volume pela temperatura, temos a pressão sendo representada por uma reta inclinada. Essa reta será decrescente quando estivermos diminuindo o volume e a temperatura, e será crescente quando estivermos aumentando o volume e a temperatura, como podemos ver no gráfico abaixo:
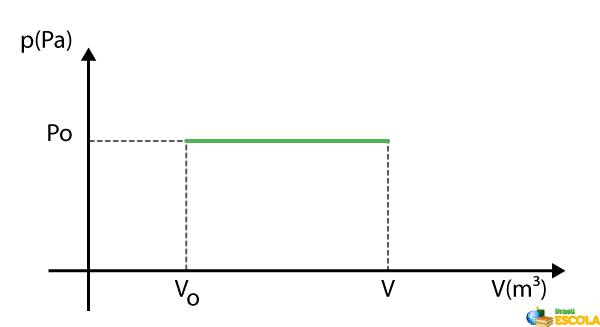
→ Gráfico da transformação isobárica p x V
No gráfico da pressão pelo volume, temos a pressão como uma reta constante, demonstrando que, independentemente da alteração do volume, na transformação isobária, a pressão se mantém, como podemos ver no gráfico abaixo:
Exercícios resolvidos sobre transformação isobárica
Questão 1
Um gás, em um recipiente A, que apresenta volume de 50 l, temperatura de 270 K e pressão de 2 atm passa por uma transformação isobárica em que seu volume aumenta para 150 l. Em vista disso, para qual valor foi modificada sua temperatura?
A) 270 K
B) 490 K
C) 650 K
D) 730 K
E) 810 K
Resolução:
Alternativa E
Calcularemos a temperatura final do gás por meio da fórmula que relaciona a pressão, a temperatura e o volume:
\(\frac{p_o\cdot V_o}{T_o}=\frac{p\cdot V}T\)
Como o gás passou por uma transformação isobárica, sua pressão se manteve constante, então podemos eliminá-la da fórmula:
\(\frac{V_o}{T_o}=\frac{ V}T\)
\(\frac{50}{270}=\frac{150}T\)
Fazendo uma multiplicação cruzada:
\(50\cdot T=150\cdot270\)
\(50\cdot T=40.500\)
\(T=\frac{40.500}{50}\)
\(T=810\ K\)
Questão 2
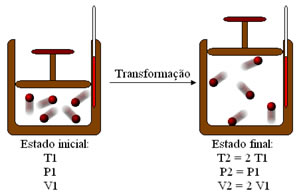
(UFRGS) Considere a seguinte transformação que ocorre com uma amostra gasosa de massa “m” apresentando comportamento de gás ideal.
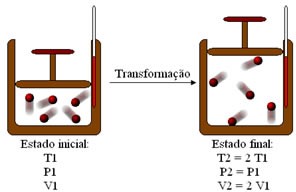
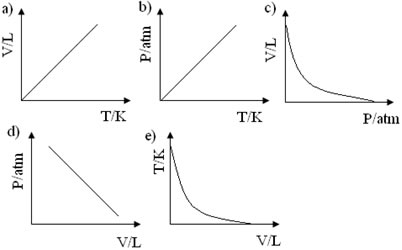
O gráfico que melhor representa essa transformação é:
A) 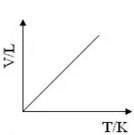
B) 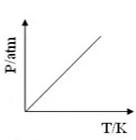
C) 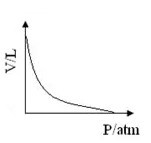
D) 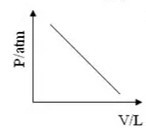
E) 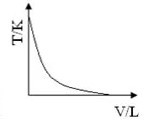
Resolução:
Alternativa A
Nessa amostra gasosa, durante a transformação, manteve-se o valor da pressão, em razão disso, trata-se de uma transformação isobárica. Para essa transformação, o gráfico pode ser dado pela relação entre o volume e a temperatura, correspondendo a uma reta inclinada, ou ser dado pela relação entre a pressão e o volume, correspondendo a uma reta constante.
Nota
|1| SCHULZ, Daniel. Transformação isobárica. In: Aprendizagem significativa de termodinâmica no ensino médio através do estudo das máquinas térmicas como tema motivador. URFGS, 2009. Disponível em www.if.ufrgs.br/~dschulz/web/isobarica.htm.
Por Pâmella Raphaella Melo
Professora de Física