O volume ocupado por um gás é diretamente proporcional à sua quantidade de moléculas (número de mol), considerando as mesmas condições de temperatura e pressão.
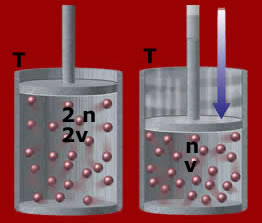
Repare na ilustração acima, ambos os recipientes estão contidos com o mesmo gás e submetidos às mesmas condições de temperatura e pressão. Se diminuirmos o número de mol de 2 n para n, o volume também diminui: passa de 2V para V.
Com isso concluímos que a relação entre volume e número de mol é constante:
V = K
n
Volume molar de gases: volume ocupado por um mol de qualquer gás, a uma determinada pressão e temperatura.
Volume molar = 22,4 L/mol
Esse valor é resultado de experimentos feitos em Condições Normais de Temperatura e Pressão (CNTP) – 1 atm e 273 K.
O volume molar segue a Hipótese de Avogadro (criada em 1811 por Amedeo Avogadro), onde volumes iguais de diferentes gases, a uma mesma temperatura e pressão, possuem mesmo número de mols.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Veja mais!
Lei dos gases e aerossóis