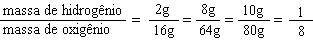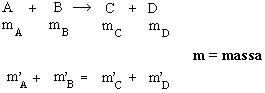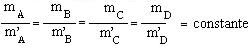Tópicos deste artigo
- 1 - Lei volumétrica de Gay-Lussac
- 2 - Leis de Proust (Lei das proporções constantes ou lei das proporções definidas)
Lei volumétrica de Gay-Lussac
Gay Lussac foi um físico e químico francês que é conhecido na atualidade por suas contribuições científicas, e uma delas é a Lei dos gases.
Outra grande contribuição de Gay-Lussac é a sua Lei volumétrica, onde ele afirma que nas mesmas condições de temperatura e pressão, os volumes dos gases participantes de uma reação têm entre si uma relação de números inteiros e pequenos.
Na Química e na Física a Lei de Gay-Lussac é uma lei dos gases perfeitos: sob volume constante, a pressão de uma quantidade constante de gás aumenta proporcionalmente com a temperatura:
P = K
T
onde:
P é a pressão do gás
T é a temperatura do gás (em kelvins)
k é uma constante
Podemos resumir num único enunciado:
A proporção volumétrica dos gases em uma reação (volumes medidos na mesma pressão e temperatura) é constante e de números inteiros e pequenos.
Exemplo:
Decomposição do vapor d’água: essa tese foi publicada em 1808, por Gay-Lussac, e envolve a reação entre hidrogênio e oxigênio.
| Experiência | Volume decomposto de vapor d'água | Volume produzido de gás hidrogênio | Volume produzido de gás oxigênio |
| 1º | 1L | 1L | 0,5L |
| 2º | 2L | 2L | 1L |
| 3º | 4L | 4L | 2L |
Proporção volumétrica
Vvapor d’água : Vhidrgênio : Voxigênio = 2 : 2 : 1
Leis de Proust (Lei das proporções constantes ou lei das proporções definidas)
Proust fez análises qualitativas e quantitativas de inúmeras substâncias adquiridas por diferentes processos e verificou que uma mesma substância tinha sempre a mesma composição qualitativa e quantitativa.
Assim, qualquer amostra de cloreto de sódio apresentava sempre sódio e cloro combinados na mesma proporção em massa. Surgiu, então, a lei:
Uma mesma substância apresenta sempre os mesmos elementos cujas massas estão em proporção constante.
| Experiência | Massa da água decomposta | Massa de hidrogênio obtida | Massa de oxigênio obtida |
| 1º | 18g | 2g | 16g |
| 2º | 72g | 8g | 64g |
| 3º | 90g | 10g | 80g |
Comparando-se a proporção entre as massas de hidrogênio e oxigênio em casa experiência, temos:
Conclusão:
A substância pura água é formada de hidrogênio e oxigênio, sempre na proporção constate de 1/8 em massa. A lei de Proust foi posteriormente estendida a qualquer reação química.
Em uma reação química, há uma proporção constante entre as massas das substâncias participantes.
Esquematizando:
Por Líria Alves
Graduada em Química