Transformações gasosas são processos em que um gás pode ter um ou mais de seus parâmetros de pressão, volume e temperatura alterados. Existem transformações gasosas especiais, nas quais pelo menos uma dessas grandezas é mantida constante.
São tipos de transformações gasosas:
-
transformação isobárica;
-
transformação isotérmica;
-
transformação isovolumétrica;
-
transformação adiabática.
Veja também: Termologia — o estudo dos fenômenos ligados ao calor e à temperatura
Tópicos deste artigo
- 1 - Transformação isotérmica
- 2 - Transformação isobárica
- 3 - Transformação isovolumétrica
- 4 - Exemplos de transformações gasosas
- 5 - Exercícios resolvidos sobre transformações gasosas
Transformação isotérmica
A transformação isotérmica é aquela em que a temperatura de um gás se mantém constante. Nesse tipo de transformação, pressão e volume são inversamente proporcionais, de modo que, aumentando-se a pressão, diminui-se o volume e vice-versa.
As transformações isotérmicas são descritas pela Lei de Boyle-Mariotte. De acordo com essa lei, o produto entre a pressão e o volume de um gás ideal é constante:
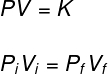
Pi e Pf – pressão inicial e final
Vi e Vf – velocidade inicial e final
K – constante
Transformação isobárica
A transformação isobárica é caracterizada por uma variação de volume e temperatura, mantendo-se a pressão constante. Esse tipo de transformação é descrito matematicamente pela lei de Charles e Gay-Lussac. Durante uma transformação isobárica, a temperatura e o volume são diretamente proporcionais, isto é, mantendo-se constante a pressão de um gás, o volume por ele ocupado aumentará de acordo com o aumento da temperatura desse gás.
Veja a fórmula utilizada pela lei de Gay-Lussac:
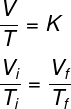
Ti e Tf – temperatura inicial e final
De acordo com a Lei de Gay-Lussac, a razão entre o volume e a pressão de um gás, durante uma transformação isobárica, é igual a uma constante.
Transformação isovolumétrica
Transformação isovolumétrica, isométrica ou ainda isocórica é o nome do processo em que um gás ideal sofre mudanças de pressão e temperatura, mantendo-se constante o seu volume. Esse tipo de transformação gasosa, que ocorre dentro de recipientes de paredes rígidas, é matematicamente definido pela Lei de Charles.
De acordo com essa lei, a razão entre a pressão e a temperatura de um gás ideal é sempre constante. Além disso, nesse tipo de transformação, pressão e temperatura são diretamente proporcionais: dobrando-se a pressão, dobramos a temperatura e vice-versa.
A fórmula que descreve o comportamento dos gases ideais durante transformações isovolumétricas é a seguinte:
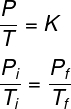
Leia também: Termodinâmica — área da Física que estuda fenômenos em que há trocas de calor
Transformação adiabática
Transformação adiabática é o nome do processo sofrido por um gás que não troca calor com o meio externo ou ainda com as paredes do seu recipiente. A fórmula que explica matematicamente o comportamento de um gás ideal que sofre uma transformação adiabática afirma que o produto entre a pressão e o volume elevado a uma constante γ é constante.
![]()
A constante γ depende dos graus de liberdade do gás, isto é, do número de direções em que as moléculas do gás podem mover-se. Também pode ser calculada pela razão entre o calor específico em pressão constante e calor específico em volume constante.
Exemplos de transformações gasosas
-
Transformação isotérmica – qualquer expansão ou contração lenta de um gás que ocorra em uma temperatura constante.
-
Transformação isobárica – resfriamento do gás contido em uma bexiga colocada para esfriar num refrigerador.
-
Transformação isovolumétrica – aquecimento do vapor de água confinado em uma panela de pressão completamente.
-
Transformação adiabática – gás sendo expelido por um spray de aerossol.

Veja também: Calorimetria – fórmulas, conceitos e exercícios resolvidos
Exercícios resolvidos sobre transformações gasosas
Questão 1 — Analise as alternativas abaixo e assinale a resposta que contém somente alternativas verdadeiras.
I – Transformações isotérmicas são aquelas em que a temperatura do gás é mantida constante.
II – Transformações adiabáticas envolvem trocas de calor entre o gás e o meio externo.
III – Transformação isocórica é aquela em que a pressão do gás é mantida constante.
IV – Transformações isobáricas acontecem com pressão constante.
São corretas:
a) I e II.
b) I, II e III.
c) II e III.
d) I e IV.
Resolução:
As alternativas II e III estão erradas, uma vez que as transformações adiabáticas não envolvem trocas de calor, e as transformações isocóricas são aquelas que acontecem em volumes constantes. Dessa maneira, a alternativa correta é a letra D.
Questão 2 — Um gás ideal sofre uma transformação rápida, de modo que sua temperatura, pressão e volume sofrem variações bruscas em um curto intervalo de tempo. De acordo com os seus conhecimentos sobre as transformações gasosas, a transformação sofrida pelo gás foi:
a) isotérmica.
b) isobárica.
c) adiabática.
d) isovolumétrica.
Resolução:
As transformações adiabáticas ocorrem de forma rápida, de modo que não há tempo para que o gás realize trocas de calor com o meio externo. Nesse tipo de transformação, os parâmetros de pressão, volume e temperatura mudam de forma abrupta. Dessa maneira, a alternativa correta é a letra C.
Por Rafael Helerbrock
Professor de Física
