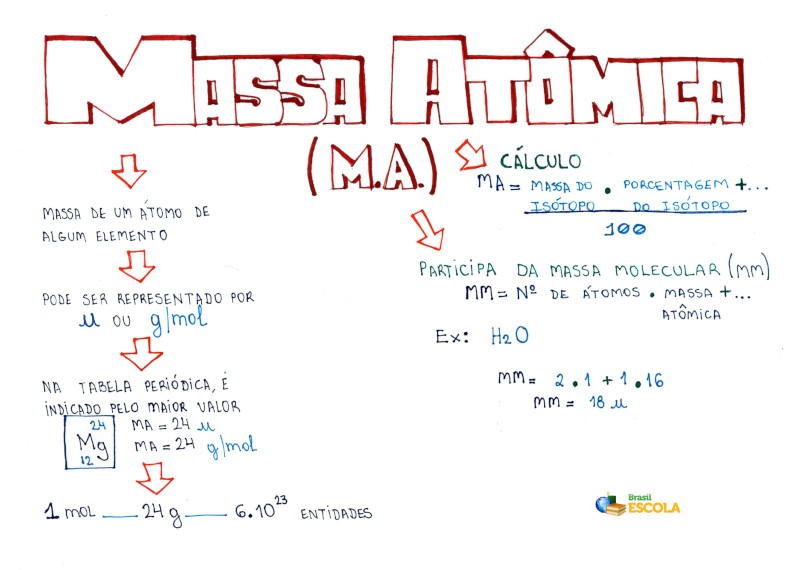
O cálculo da massa atômica de um elemento é o recurso matemático utilizado para determinar o valor da massa presente na Tabela Periódica de cada um dos elementos químicos existentes. De forma geral, para realizar o cálculo da massa atômica, devemos conhecer as seguintes variáveis do elemento químico:
-
Isótopos do elemento;
-
Número de massa de cada isótopo do elemento;
-
Porcentagem de cada isótopo do elemento na natureza.
O cálculo da massa atômica do Hidrogênio, por exemplo, foi realizado com base nos seguintes dados:
-
Apresenta os isótopos prótio (H1), deutério (H2) e trítio (H3);
-
As massas desses isótopos são 1, 2 e 3 respectivamente;
-
A porcentagem do Prótio na natureza é de 98,9%;
-
A porcentagem do Deutério na natureza é de 0,09%;
-
A porcentagem do Trítio na natureza é de 0,01%.
Padrão matemático do cálculo da massa atômica
Para realizar o cálculo da massa atômica de qualquer elemento químico, devemos utilizar o seguinte padrão matemático:
-
1o: multiplicar o número de massa de cada isótopo pela sua porcentagem;
-
2o: somar todos os resultados encontrados nas multiplicações do primeiro passo;
-
3o: dividir a somatória encontrada por 100.
M.A. = número de massa.porcentagem + número de massa.porcentagem
100
Tópicos deste artigo
Mapa Mental: Massa Atômica
* Baixe o mapa mental sobre massa atômica!
Exemplos de cálculo da massa atômica
⇒ 1º exemplo: Cálculo da massa atômica do Enxofre.
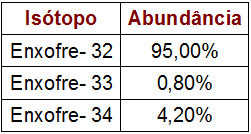
Dados sobre a porcentagem e a massa dos isótopos do Enxofre
A tabela fornecida indica o número de massa e a porcentagem de cada isótopo do enxofre na natureza. Para realizar o cálculo da massa atômica, basta realizar os seguintes passos:
1o Passo: multiplicar o número de massa de cada isótopo pelo valor da sua abundância.
-
Enxofre - 32 (S32)
S32 = 32.95
S32 = 3040
-
Enxofre - 33 (S33)
S33 = 33.0,8
S33 = 26,4
-
Enxofre - 34 (S34)
S34 = 34.4,2
S34 = 142,8
2o Passo: somar os valores encontrados nas multiplicações do número de massa e a abundância do isótopo.
Soma = S32 + S33 + S34
Soma = 3040 + 26,4 + 142,8
Soma = 3209,2
3o Passo: calcular a massa atômica dividindo a soma dos resultados encontrados por 100:
M.A. = Soma
100
M.A. = 3209,2
100
M.A. = 32,092 u
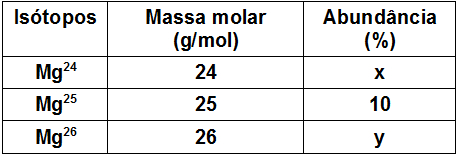
⇒ 2º exemplo: Um determinado elemento químico (D) apresenta três isótopos, cujos números de massa são:
30D 32D 34D
Sabendo que a massa atômica desse elemento é 32,20 u e que há 20% do isótopo 32D na natureza, qual é o valor das porcentagens dos demais isótopos?
O enunciado fornece os números de massa, a massa atômica e a porcentagem de um dos isótopos. Para determinar as porcentagens dos outros isótopos, devemos realizar os seguintes passos:
1o Passo: determinar a porcentagem de cada isótopo.
-
Isótopo - 30 (DS30)
DS30 = 30.x
DS30 = 30x
-
Isótopo - 32 (DS32)
DS32 = 32.20
DS32 = 640
-
Isótopo - 34 (D34)
DS34 = 34.y
DS34 = 34y
2o Passo: utilizar todos os dados encontrados na expressão matemática para o cálculo da massa atômica.
M.A. = número de massa.porcentagem + número de massa.porcentagem
100
32,2 = 30x + 640 + 34y
100
32,2.100 = 30x + 640 + 34y
100
3220 – 640 = 30x+34y
30x + 34y = 2580
x = 2580 – 34y
30
3o Passo: utilizar a expressão encontrada acima a partir do seguinte raciocínio:
Porcentagem do isótopo 1 + Porcentagem do isótopo 2 + Porcentagem do isótopo 3 = 100%
x + 20 + y = 100
x + y = 100 – 20
x + y = 80
x = 80 – y
2580 – 34y = 80-y
30
2580 – 34y = 30. (80-y)
2580- 34 y = 2400 – 30y
2580 – 2400 = 34y-30y
4y = 180
y = 80
4
y = 45%
4o Passo: calcular o valor da porcentagem de x na expressão construída no terceiro passo.
x + y = 80
x + 45 = 80
x = 80 – 45
x = 35%
Por Me. Diogo Lopes Dias