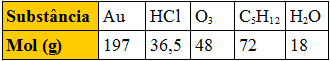
Qual a relação que existe entre 1 mol e o número de Avogadro? Comecemos definindo o que é mol:
O mol é a quantidade de matéria de um sistema que contém tantas entidades elementares quanto são os átomos contidos em 0,012 quilogramas de carbono 12.
Mas o que é carbono 12? 12C é o isótopo do elemento carbono com 6 prótons, 6 nêutrons e 6 elétrons, ele tem um papel muito importante na Química. O Carbono 12 foi escolhido como padrão de referência para a medida das massas atômicas porque é o mais abundante de todos os isótopos do elemento carbono, ocorre na natureza na porcentagem relativa de 98,94%. Outros isótopos do carbono como o 13C e 14C são encontrados em menores quantidades.
Voltemos à pergunta inicial: a relação entre mol e número de Avogadro. O número de entidades elementares contidas em 1 mol correspondem à constante de Avogadro, cujo valor é 6,02 x 1023 mol-1. Esta comparação foi estipulada porque 1 mol coincide com o número de Avogadro.
Sendo assim ficou definido que 1 mol de átomos é igual a 6,02 x 1023 , e 1 mol contém 12 gramas (equivalente ao 12C).
1 mol = 6,02 x 1023 = 12 gramas
Estudando este conteúdo pode surgir uma dúvida: de onde vem o número de Avogadro?
É proveniente dos estudos de Amedeo Avogadro (1786-1856), este cientista estudava os gases quando enunciou uma hipótese, mais tarde suas pesquisas foram reconhecidas e surgiu então a constante de Avogadro, em sua homenagem.
Agora um exemplo do cálculo da quantidade de átomos baseado na constante de Avogadro:
Como calcular a quantidade de átomos em 50 gramas de Sódio (Na)?
Massa atômica do Sódio = 23 g (gramas)
Estabelecendo uma relação com o número de Avogadro temos:
1 mol de Na = 23 g = 6,02 x 1023
Pela regra de três teremos:
Em 23 g (Na) têm-se 6,02 x 1023 átomos
Então em 50 g teremos X átomos
Calculando:
23 — 6,02 x 1023
50 — X
X = 50 • 6,02 x 1023
23
X = 13,08 x 1023 átomos de Sódio (Na)
Por Líria Alves
Graduada em Química