A concentração de uma solução é usada para indicar a relação entre as quantidades de soluto e solvente que formam determinada solução. De modo geral, a concentração é definida pela razão entre a quantidade de soluto e a quantidade de solução; e pode ser dada pela quantidade de massa, ou de matéria (n), e pelo volume, ou massa, total da solução.
Pode ser expressa de diferentes formas, considerando-se a finalidade de sua aplicação. Por exemplo, a concentração comum, dada em g/L, é a mais usual e muito utilizada para expressar quantidades significativas do soluto presente na solução. O título percentual é comumente utilizado para expressar a relação de soluto em soluções alcoólicas. Já a concentração molar, dada em mol/L, é muito utilizada para expressar pequenas quantidades de soluto na solução.
Vale destacar que a concentração da solução é o principal parâmetro utilizado pelos consumidores, ainda que de forma inconsciente, para mensurar a relação custo-benefício de diferentes produtos consumidos por meio dos rótulos e especificações dos produtos, desde alimentos a produtos de limpeza.
Leia também: Como se calcula o pH de uma solução?
Tópicos deste artigo
- 1 - Resumo sobre concentração de soluções
- 2 - Tipos de concentração de soluções
- → Concentração comum (C)
- → Densidade da solução (d)
- → Concentração massa/massa ou título em massa (Tm)
- → Concentração volume/volume ou título em volume (TV)
- → Partes por milhão (ppm)
- → Concentração em quantidade de matéria (m)
- → Concentração em quantidade de matéria por massa (W)
- → Fração em quantidade de matéria ou fração molar (X)
- 3 - Fórmulas da concentração de soluções
- 4 - Como calcular a concentração de soluções?
- 5 - Exercícios resolvidos sobre concentração de soluções
Resumo sobre concentração de soluções
- A concentração de uma solução é a razão que indica a relação entre as quantidades de soluto e solvente que formam determinada solução.
- O cálculo da concentração de soluções é dado, de modo geral, estabelecendo-se a razão entre a quantidade de soluto e a quantidade de solução (soluto/solução).
- Os diferentes tipos de concentração de soluções são:
- Concentração comum (C), dada pela razão massa/volume (m/v);
- Densidade da solução (d), dada pela razão massa/volume (m/v);
- Título (T), dado pela razão massa/massa (m/m) ou pela razão volume/volume (v/v);
- Partes por milhão (ppm), dado pela razão massa/massa (m/m) ou pela razão volume/volume (v/v);
- Concentração em quantidade de matéria (m), dada pela razão mol/volume (mol/v);
- Molalidade (W), dada pela razão mol/massa (mol/m);
- Fração molar (X), dada pela razão mol/mol (mol/mol).
Tipos de concentração de soluções
A concentração de uma solução pode ser expressa de diferentes formas, com o objetivo de especificar a quantidade de massa ou de matéria presente na mistura de acordo com a finalidade de sua aplicação.
→ Concentração comum (C)
Também conhecida como concentração em massa, é a expressão de concentração mais utilizada e estabelece a relação entre a quantidade de massa, em gramas (g), e o volume da solução, em litro (L), como mostra a relação abaixo.
\(C=\frac{m_1}{V}\)
- C – concentração comum.
- m1 – massa do soluto, em grama (g).
- V – volume da solução, em litro (L).
- Unidade padrão: g/L.
Apesar de a unidade padrão ser o grama por litro (g/L), ela também costuma ser dada por diferentes relações de massa e volume, como mg/L, mg/mL ou Kg/m3.
→ Densidade da solução (d)
A densidade relaciona a quantidade de massa presente em cada unidade de volume. Dessa forma, a densidade da solução é a relação entre a massa da solução e o volume da solução.
\(d=\frac{m}{V}\)
Considerando que a massa da solução é a soma da massa do soluto (m1) e do solvente (m2), a densidade da solução pode ser dada por:
\(d=\frac{m_1+m_2}{V}\)
- d – densidade da solução.
- m1 – massa do soluto.
- m2 – massa da solução.
- V – volume da solução.
- Unidade padrão: kg/m3.
Apesar de a unidade padrão ser o quilograma por metro cúbico (kg/m3), é muito comum a unidade ser dada em grama por centímetro cúbico (g/cm3) ou, o seu equivalente, grama por mililitro (g/mL).
→ Concentração massa/massa ou título em massa (Tm)
É a razão entre a massa do soluto (m1) e a massa da solução (m), ambas na mesma unidade de medida.
\(T_m = \frac{m_1}{m}\)
Como a massa da solução é dada pela soma da massa do soluto e do solvente, o título pode ser definido por meio da seguinte expressão:
\(T_m = \frac{m_1}{m_1 +m_2}\)
- Tm – título em massa.
- m1 – massa do soluto.
- m2 – massa do solvente.
- Unidade padrão: não há unidade (adimensional).
O valor do título é normalmente expresso em porcentagem de soluto presente na solução, e pode ser definido pela expressão:
\(T_m\%=T_V\cdot 100\)
→ Concentração volume/volume ou título em volume (TV)
É a razão entre o volume do soluto (V1) e o volume da solução (V), ambas na mesma unidade de medida.
\(T_V=\frac{V_1}{V} \ \ \ ou \ \ \ T_V=\frac{V_1}{V_1+V_2}\)
- TV – título em volume.
- V1 – volume do soluto.
- V2 – volume do solvente.
- Unidade padrão: não há unidade (adimensional).
O título percentual em volume é dado pela expressão:
\(T_m\%=T_V\cdot 100\)
→ Partes por milhão (ppm)
Indica a quantidade de soluto presente em um milhão de partes da solução. Considerando a relação entre a massa do soluto e a massa do solvente, na mesma unidade de medida, o ppm pode ser dado pela expressão:
\(ppm = \frac{m_1}{m}\cdot 10^6\)
A relação massa por massa (m/m) utilizada para o ppm, quando as unidades são diferentes, é:
\(\frac{m_1}{m} = \frac{1\,\text{g}}{1\,\text{t}} = \frac{1\,\text{mg}}{1\,\text{kg}} = \frac{1\,\mu\text{g}}{1\,\text{g}} = 1\,\text{ppm} \)
A concentração em ppm também pode ser dada por meio da razão do volume do soluto pelo volume da solução, dados na mesma unidade de volume:
\(ppm=\frac{V_1}{V}\cdot 10^6\)
A relação volume por volume (v/v) utilizada para o ppm, quando as unidades são diferentes, é:
\(\frac{V_1}{V} = \frac{1\,\text{L}}{1000\,\text{m}^3} = \frac{1\,\text{mL}}{1\,\text{m}^3} = \frac{1\,\mu\text{L}}{1\,\text{L}} = 1\,\text{ppm} \)
→ Concentração em quantidade de matéria (m)
Também chamada de concentração molar, é a razão da quantidade de matéria do soluto (n1) por volume da solução em litros (L), como mostra a expressão a seguir.
\(m=\frac{n_1}{V}\)
- 𝑚 – concentração em quantidade de matéria.
- n1 – quantidade de matéria do soluto, dada em mol (mol).
- V – volume da solução, dado em litro (L).
- Unidade padrão: mol/L.
A concentração em quantidade de matéria também pode ser deduzida com base no valor de massa, considerando que:
\(n_1=\frac{m_1}{M_1}\)
Em que m1 é a massa do soluto e M1 é a massa molar (g/mol) do soluto.
Assim, temos que:
\(m=\frac{m_1}{M_1\cdot V}\)
→ Concentração em quantidade de matéria por massa (W)
Também conhecida como molalidade, é a razão entre a quantidade de matéria do soluto (n1) e a massa do solvente, em quilograma (kg), que pode ser dada pelas seguintes expressões:
\(W=\frac{n_1}{m_2}\ \ \ ou\ \ \ W=\frac{m_1}{M_1\cdot m_2}\)
- W – concentração em quantidade de matéria por massa.
- n1 – quantidade de matéria do soluto, dada em mol (mol).
- m2 – massa do solvente, dada em quilograma (kg).
- M1 – massa molar (g/mol) do soluto.
- Unidade padrão: mol/kg.
→ Fração em quantidade de matéria ou fração molar (X)
É a concentração dada pela razão entre a quantidade de matéria e quantidade de matéria. Pode ser de duas formas:
- Fração em quantidade de matéria do soluto (X1): dada pela razão entre a quantidade de matéria do soluto (n1) e a quantidade de matéria da solução (n).
\(X_1=\frac{n_1}{n}\)
Como a quantidade de matéria da solução é n = n1 + n2, tem-se:
\(X_1=\frac{n_1}{n_1+n_2}\)
- Fração em quantidade de matéria do solvente (X2): é dada pela razão entre a quantidade de matéria do solvente (n2) e a quantidade de matéria da solução (n).
\(X_2=\frac{n_2}{n}\)
Como a quantidade de matéria da solução é n = n1 + n2, tem-se:
\(X_2=\frac{n_2}{n_1+n_2}\)
A fração molar é adimensional, ou seja, não apresenta unidade.
Veja também: O que é o coeficiente de solubilidade de uma solução?
Fórmulas da concentração de soluções
A concentração de uma solução pode ser deduzida por diferentes fórmulas que estabelecem a razão entre a quantidade de soluto e a quantidade de solução, como expresso a seguir.
|
Concentração |
Fórmula |
Unidade |
|
Concentração comum (C) |
\(C=\frac{m_1}{V}\) |
g/L; mg/L; mg/mL; kg/m3. |
|
Densidade da solução (d) |
\(d=\frac{m_1+m_2}{V}\) |
kg/cm3; g/cm3; g/mL. |
|
Título em massa (Tm), razão m/m |
\(T_m = \frac{m_1}{m}\) ou \(T_m = \frac{m_1}{m_1 +m_2}\) |
adimensional |
|
Título em volume (TV), razão v/v |
\(T_V=\frac{V_1}{V}\) ou \(T_V=\frac{V_1}{V_1+V_2}\) |
adimensional |
|
Título percentual (T%) |
T% = T · 100 |
adimensional |
|
Partes por milhão (ppm), razão m/m |
\(ppm = \frac{m_1}{m}\cdot 10^6\) |
ppm |
|
Partes por milhão (ppm), razão v/v |
\(ppm=\frac{V_1}{V}\cdot 10^6\) |
ppm |
|
Concentração em quantidade de matéria (m) |
\(m=\frac{n_1}{V}\)
ou \(m=\frac{m_1}{M_1\cdot V}\) |
mol/L |
|
Concentração em quantidade de matéria por massa (W) |
\(W=\frac{n_1}{m_2}\) ou \(W=\frac{m_1}{M_1\cdot m_2}\) |
mol/kg |
|
Fração em quantidade de matéria do soluto (X1) |
\(X_1=\frac{n_1}{n}\) ou \(X_1=\frac{n_1}{n_1+n_2}\) |
adimensional |
|
Fração em quantidade de matéria do solvente (X2) |
\(X_2=\frac{n_2}{n}\) ou \(X_2=\frac{n_2}{n_1+n_2}\) |
adimensional |
Como calcular a concentração de soluções?
O cálculo da concentração é feito estabelecendo-se a razão entre a quantidade de soluto e a quantidade de solução. Para entender melhor como se dá o cálculo dos diferentes tipos de concentração, vamos considerar uma solução formada por 2 g de hidróxido de sódio (NaOH) dissolvidos em 500 mL de água.
- Cálculo da concentração comum (C): a massa do soluto (m1) é 2 g e o volume deve ser dado em litro (L). Dessa forma, é preciso fazer a conversão de mL para L; logo, 500 mL = 0,5 L. Assim, temos que:
\(C=\frac{m_1}{V}\)
Substituindo os valores, temos que:
\(C = \frac{2\,\text{g}}{0{,}5\,\text{L}} = 4\,\text{g/L} \)
O valor da concentração indica que existem 4 g de NaOH a cada litro de solução.
- Cálculo da densidade (d): a densidade dessa solução pode ser definida pelos valores de massa do soluto (m1) e do solvente. Como a densidade da água é 1 g/mL, os 500 mL equivalem a 500 g de água. Assim, como m1 = 2 g e m2 = 500 g, temos:
\(d = \frac{m_1 + m_2}{V} = \frac{2\,\text{g} + 500\,\text{g}}{500\,\text{mL}} = 1{,}004\,\text{g/mL} \)
O valor da densidade indica que existem 1,004 g de NaOH a cada mililitro de solução.
- Cálculo do título (Tm/m): essa solução também pode ser expressa na concentração em título por meio da relação massa/massa. Como m1 = 2 g e m2 = 500 g e a massa da solução (m) é dada por m1 + m2, temos:
\(T_{(m/m)} = \frac{m_1}{m} = \frac{m_1}{m_1 + m_2} \)
\(T_{(m/m)} = \frac{m_1}{m} = \frac{m_1}{m_1 + m_2} \)
Como o título é comumente expresso em título percentual, temos:
T% = T·100
T% = 0,00398·100
T% = 0,398%
Esse valor indica que 0,398% da massa dessa solução é composto por hidróxido de sódio (NaOH).
- Cálculo das partes por milhão (ppm): o cálculo do ppm segue a mesma linha de raciocínio do título. Entretanto, a razão m/m é multiplicada por 106 (1 milhão) para se chegar ao valor de ppm. Como definido anteriormente, m1 = 2 g e m = 502 g. Assim, temos:
\(ppm = \frac{m_1}{m}\cdot 10^6\)
\(ppm = \frac{2g}{502g}\cdot 10^6\)
\(ppm=3.984,06 ppm\)
Esse valor indica que existem 3.984,06 partes de hidróxido de sódio a cada 1 milhão (106) de partes da solução.
- Cálculo da concentração em quantidade de matéria (m): a concentração molar (mol/L) da solução pode ser determinada por meio da relação entre a quantidade de massa de NaOH (2g), sua massa molar (MNaOH ≈ 40 g/mol) e o volume da solução em litros (500 mL = 0,5 L), como descrito a seguir.
\(m=\frac{m_1}{M_1\cdot V}\)
\(m = \frac{2\,\text{g}}{40\,\text{g/mol} \cdot 0{,}5\,\text{L}} \)
\(m=0,1mol/L\)
Esse valor indica que existe 0,1 mol de hidróxido de sódio (NaOH) a cada um litro dessa solução.
- Cálculo da concentração em quantidade de matéria por massa (W): a molalidade (W) da solução pode ser obtida pela razão entre a massa do NaOH (2g), sua massa molar (MNaOH ≈ 40 g/mol) e a massa de água, em quilogramas (500g = 0,5 Kg), utilizada no preparo da solução. Assim, temos:
\(W = \frac{m_1}{M_1 \cdot m_2}\\ W = \frac{2\,\text{g}}{40\,\frac{g}{mol} \cdot 0{,}5\,\text{kg}}\\ W = 0{,}1\,\text{mol/kg} \)
Esse valor indica que existe 0,1 mol de NaOH a cada um quilograma dessa solução.
- Cálculo da fração em quantidade de matéria ou fração molar (X): a fração molar da solução pode ser calculada em relação ao soluto (X1) ou ao solvente (X2) por meio das seguintes expressões:
\(X_1=\frac{n_1}{n_1+n_2}\) ou \(X_2=\frac{n_2}{n_1+n_2}\)
Para calcular a fração molar, faz-se necessário determinar a quantidade de matéria (n) relacionada à massa do NaOH e à massa de água utilizada no preparo da solução.
-
- Determinação da quantidade de matéria do NaOH: pela razão entre a massa de NaOH (2g) e sua massa molar (MNaOH ≈ 40 g/mol), temos:
\(n_1=\frac{m_1}{M_1} =\frac{2g}{40 g⁄mol}=0,05mol\)
-
- Determinação da quantidade de matéria da água (H2O): pela razão entre a massa da água (500g) e sua massa molar (MH2O ≈ 18 g/mol), temos:
\(n_2=\frac{m_2}{M_2} =\frac{500g}{18 g⁄mol}=27,77mol\)
Após a determinação da quantidade de matéria do soluto (n1) e do solvente (n2), podemos determinar a fração molar (X) da solução substituindo os valores na expressão.
Em relação ao soluto (NaOH), temos:
\(X_1 = \frac{n_1}{n_1 + n_2}\\ X_1 = \frac{0{,}05\,\text{mol}}{0{,}05\,\text{mol} + 27{,}77\,\text{mol}}\\ X_1 = \frac{0,05 mol}{27,82mol} \approx 0,0018 \)
Esse valor indica que 0,18% dessa solução é formado por hidróxido de sódio (NaOH).
Em relação ao solvente (H2O), temos:
\(X_1 = \frac{n_1}{n_1 + n_2}\\ X_1 = \frac{27,77\text{mol}}{0,05\,\text{mol} + 27,77\,\text{mol}}\\ X_1 = \frac{27,77 mol}{27,82mol} \approx 0,9982 \)
Esse valor indica que 99,82% dessa solução são formados por água.
Dessa forma, foi possível verificar que a concentração de uma solução formada por 2 g de NaOH dissolvidos em 500 mL de água pode ser escrita de diferentes formas, e, apesar dos diferentes valores obtidos, todas representam uma relação de quantidade de soluto presente na quantidade total de solução.
Saiba mais: Número de mol — o que é e como calcular?
Exercícios resolvidos sobre concentração de soluções
Questão 1: (Enem 2024) O soro caseiro serve para combater a desidratação por meio da reposição da água e sais minerais perdidos, por exemplo, por diarreia. Uma receita simples para a sua preparação consiste em utilizar duas colheres grandes (de sopa) de açúcar e duas colheres pequenas (de café) de sal de cozinha, dissolvidos em 2 L de água fervida, obtendo-se uma solução com concentração de íon sódio de 1,4 mg/mL.
Considere as massas molares: NaCl = 58,5 g/mol; Na = 23 g/mol.
Qual é o valor mais próximo da massa, em grama, de cloreto de sódio presente em uma única colher pequena?
A) 0,7 g
B) 1,8 g
C) 2,8 g
D) 3,6 g
E) 7,0 g
Resposta: Alternativa D): 3,6 g.
Resolução: O primeiro passo é determinar a quantidade de íons Na+ presente na solução, que apresenta uma concentração de íons Na+ de 1,4 mg/mL. Como o volume da solução foi dado em litros, precisamos convertê-lo para mililitros; assim, temos que 2 L = 2000 mL.
Pela relação de concentração comum:
\(C=\frac{m_1}{V}\)
Podemos definir a massa do íon sódio:
\(m_1=C\cdot V\\ m_1=1,4mg/mL\cdot 2000mL\\ m_1=2800 mg\)
Como o valor do cloreto de sódio é pedido em gramas, é necessário converter o valor de massa obtido; assim, 2800 mg = 2,8 g de íon sódio.
Agora, vamos calcular a massa do cloreto de sódio (NaCl), cuja relação existente é:
1 mol de Na+ --------- 1mol de NaCl
Com base nos valores de massas molares do sódio (23 g/mol) e do cloreto de sódio (58,5 g/mol), podemos estabelecer a seguinte relação:
23g de Na+ ----------- 58,5g de NaCl
2,8g de Na+ ------------- m(g) de NaCl
\(m_{NaCl} = \frac{2,8g \cdot 58,5g}{23g} \approx 7,12 g\)
O valor encontrado, de 7,12 g, é a quantidade total de massa do cloreto de sódio adicionado em 2L de água e corresponde a duas colheres pequenas de sal, utilizadas no preparo do soro caseiro.
Entretanto, a questão pede a quantidade aproximada da massa de cloreto de sódio presente em uma única colher pequena.
Assim, a quantidade em uma colher é a metade do valor encontrado:
Massa de NaCl em 2 colheres pequenas ≈ 7,12 g.
Massa de NaCl em 1 colher pequena ≈ 3,56 g.
Dessa forma, a alternativa que apresenta o valor aproximado de cloreto de sódio em uma colher pequena é a D, com o valor de 3,6 g.
Questão 2: (Enem 2022) O ácido tartárico é o principal ácido do vinho e está diretamente relacionado com sua qualidade. Na avaliação de um vinho branco em produção, uma analista neutralizou uma alíquota de 25,0 mL do vinho com NaOH a 0,10 mol.L-1, consumindo um volume igual a 8,0 mL dessa base. A reação para esse processo de titulação é representada pela equação química:
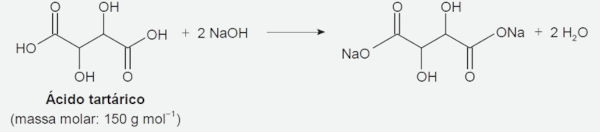
A concentração de ácido tartárico no vinho analisado é mais próxima de:
A) 1,8g.L-1
B) 2,4g.L-1
C) 3,6g.L-1
D) 4,8g,L-1
E) 9,6g.L-1
Resposta: Alternativa B): 2,4g.L-1.
Resolução: A equação química dada indica que 1 mol de ácido tartárico reage com 2 mol de hidróxido de sódio (NaOH), ou seja, a proporção é de 1:2 (ácido tartárico/NaOH).
Partindo dos valores de concentração do NaOH (0,10 mol.L-1) e do volume consumido da solução (8,0 mL = 0,008 L), é possível determinar a quantidade de mol de NaOH consumido na reação por meio da expressão da concentração em quantidade de matéria (m):
\(m=\frac{n_1}{V} \)
Em que n1 é a quantidade de matéria do NaOH (dada em mol), m é a concentração molar do NaOH (0,10 mol.L-1) e V é o volume da solução (0,008 L).
A equação pode ser reescrita como:
\(n_1=m\cdot V\)
Logo,
\(n_1=0,10mol\cdot L^{-1}\cdot 0,008L \\ n_1=0,0008mol \)
Como a proporção da reação é de 1:2 (ácido tartárico/NaOH), a quantidade de mol do ácido tartárico é a metade da quantidade de mol do NaOH, logo:
nÁcidotartárico = 0,0008mol ÷ 2 = 0,0004mol
Agora, com base na massa molar do ácido tartárico (150 g.mol-1), é possível calcular a massa de ácido presente em 0,0004 mol; assim, temos:
1mol de ácido tartárico ----------- 150 g
0,0004 mol de ácido tartárico --------- m (g)
\(m=\frac{0,0004mol\cdot 150g}{1mol}=0,06g\)
Agora, sabendo o valor de massa de ácido tartárico que reagiu (0,06 g), é possível determinar a concentração comum (dada em g.L-1) desse ácido no vinho com base no volume dado (25 mL = 0,025 L):
\(C = \frac{m_1}{V} = \frac{0{,}06\,\text{g}}{0{,}025\,\text{L}} = 2{,}4\,\text{g}\cdot\text{L}^{-1} \)
Assim, a concentração de ácido tartárico no vinho é de 2,4 g.L-1.
Fontes
ATKINS, Peter; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 3ª ed.;Porto Alegre; Bookman; 2006.
ATKINS, P. W. PAULA, J. de. Fundamentos de Físico-Química. Vol 1 & 2. 5 ed. Rio de Janeiro: LTC, 2003.
SKOOG, Douglas A (2006). Fundamentos de Química Analítica. 8ª ed. São Paulo-SP: Thomson.
![Texto sobre o que é concentração de soluções sobre um fundo verde. [imagem_principal] Texto sobre o que é concentração de soluções sobre um fundo verde. [imagem_principal]](https://s3.static.brasilescola.uol.com.br/be/2025/06/1-texto-sobre-o-que-e-concentracao-de-solucoes-sobre-um-fundo-verde-imagem-principal.jpg)
