A concentração comum é uma medida importante que mostra quanto de uma substância está presente em certa quantidade de solução. Por isso, é muito útil em várias situações, como na produção de remédios e produtos químicos, ajudando a controlar e entender melhor as propriedades das soluções que usamos no dia a dia.
Leia também: Mistura de soluções sem reação química — como isso ocorre?
Tópicos deste artigo
- 1 - Resumo sobre concentração comum
- 2 - Fórmula da concentração comum
- 3 - Como calcular a concentração comum?
- 4 - Outros tipos de concentração
- 5 - Exercícios resolvidos sobre concentração comum
Resumo sobre concentração comum
- A concentração comum representa a quantidade de soluto em determinada quantidade de solvente ou solução.
- É expressa em g/L (gramas por litro).
- É calculada pela fórmula C = m/v, em que m é a massa em gramas da substância de interesse (soluto) e v é o volume em litros da solução.
- É uma das formas mais comuns de expressar a concentração de soluções.
- Existem outros tipos de concentração: concentração em quantidade de matéria, porcentagem em massa (título), molalidade e partes por milhão.
Fórmula da concentração comum
A fórmula da concentração comum (C), conforme a Iupac, é determinada pela razão entre a massa do soluto, em gramas (g), e o volume da solução em litros (L), sendo expressa, portanto, em g/L, de acordo com expressão abaixo:
\(C=\frac{m_1}{V}\)
Onde:
C = concentração
m1 = massa do soluto em gramas
V = volume em litros
É importante ressaltar que as unidades da concentração comum não se restringem a g/L, podendo ser expressas também em mg/L, mg/mL, µg/µL. Ou seja, varia em relação a como se deseja expressar.
Como calcular a concentração comum?

Para calcular a concentração comum basta seguirmos o raciocínio da fórmula anterior, pois precisamos apenas de duas informações: a massa do soluto e o volume da solução a ser preparada. Sendo assim, vamos ver um exemplo para facilitar a compreensão:
Exemplo: Ao adicionarmos 12 g de cloreto de sódio (NaCl) em um copo e completarmos o volume com água até a marcação de 200 mL, qual concentração desse sal teremos nessa solução?
Primeiro vamos organizar os dados:
C = ?
m1 = 12 g
V = 200 mL
Veja que o volume está em mililitros, então devemos convertê-lo para litros: 200/1000 = 0,2 L. Logo,
\(C=\frac{12g}{0,2L}\)
\(C=60{g}/{L}\)
Isso significa que para cada 1 litro da solução, temos 60 g de soluto (NaCl).
Outros tipos de concentração
Além da concentração comum, existem outros tipos de concentrações que são usadas de acordo com a finalidade da solução. São elas:
- Concentração em quantidade de matéria, ou molaridade: a concentração é dada em mols/L e é usada para expressar quantos mols do soluto existem em 1 litro de solução.
- Porcentagem em massa (título): a concentração da solução é expressa em percentual do soluto contido na solução. É calculado pela razão massa do soluto/massa da solução.
- Molalidade (w): é a relação da quantidade de mols do soluto distribuídos em 1 kg do solvente. É dado pela razão mols/kg.
- Partes por milhão (ppm): é uma concentração usada para expressar concentrações em soluções extremamente diluídas, cuja concentração do soluto é pequena, porém significativa, como é o caso de contaminantes ambientais. É expressa pela razão: uma parte do soluto/1 milhão de partes da solução — ou ainda em partes por bilhão (ppb) ou trilhão (ppt).
Saiba mais: Afinal, qual é a diferença entre soluto e solvente?
Exercícios resolvidos sobre concentração comum
1) (Fuvest 2001) Considere duas latas do mesmo refrigerante, uma na versão “diet” e outra na versão comum. Ambas contêm o mesmo volume de líquido (300 mL) e têm a mesma massa quando vazias. A composição do refrigerante é a mesma em ambas, exceto por uma diferença: a versão comum contém certa quantidade de açúcar, enquanto a versão “diet” não contém açúcar (apenas massa desprezível de um adoçante artificial). Pesando-se duas latas fechadas do refrigerante, foram obtidos os seguintes resultados:
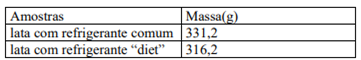
Por esses dados, pode-se concluir que a concentração, em g/L, de açúcar no refrigerante comum é de, aproximadamente,
- 0,020
- 0,050
- 1,1
- 20
- 50
Gabarito: e)
Primeiro devemos descobrir quantos gramas de açúcar há na lata de refrigerante normal. Para isso, basta fazer a diferença entre as massas das duas latas: comum – diet.
m = 331,2 – 316,2 = 15 g. Essa é a massa de açúcar contida na lata de refrigerante comum. Agora é necessário converter o volume do refrigerante de mililitros para litros, logo 300 mL/1000mL = 0,3 L. Pronto! É só aplicar na expressão: C = m/v. Sendo assim, temos:
C = 15/0,3
C = 50 g/L
2) Uma indústria química precisa preparar uma solução de hidróxido de sódio (NaOH) com concentração X. Eles têm um tanque contendo 50 kg de NaOH sólido que serão adicionados em um segundo tanque contendo 2.000 L de água. Diante disso, calcule a concentração da solução que será formada.
- 0,50 g/L
- 2,5 g/L
- 25 g/L
- 50 g/L
- 250 g/L
Gabarito: c)
50 kg equivalem a 50.000g. Logo, a concentração será dada por:
C = 50.000/2.000
C = 25 g/L
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. A concentração. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. [s.l.] Bookman, 2018. p. 54.
L. BROWN, T. et al. Concentrações de soluções. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 146–149.
SPENCER LIMA, L. Solução (Química). Revista de Ciência Elementar, v. 1, n. 1, p. 9–10, 30 dez. 2013.

