Energia térmica é um termo amplo, usado para expressar diferentes grandezas termodinâmicas, tais como energia interna ou uma quantidade de calor trocada entre sistemas de diferentes temperaturas. Neste artigo, trataremos da energia térmica como um sinônimo de energia interna, que pode ser entendida como a soma das energias cinética e potencial dos átomos e moléculas que constituem um sistema termodinâmico.
Veja também: Antes de continuar, confira um resumo incrível sobre termologia
Tópicos deste artigo
- 1 - Energia térmica
- 2 - Vantagens e desvantagens da energia térmica
- 3 - Exercícios sobre energia térmica
Energia térmica
Energia térmica é a resultado da soma da energia cinética e potencial de todas as partículas constituintes de um corpo. A energia térmica depende diretamente da temperatura absoluta do corpo, medida em kelvin (K), e também depende da quantidade de graus de liberdade do sistema, isto é: o número de direções nas quais as moléculas podem mover-se, vibrar, oscilar ou até mesmo rotacionar.

O teorema da equipartição de energia estabelece que: a cada grau de liberdade de um sistema, sua energia interna pode ser calculada a partir de um múltiplo inteiro da expressão ½ kBT, em que Kb é a constante de Boltzmann e T é a temperatura medida em kelvin. A fórmula utilizada para o cálculo da energia térmica de um gás monoatômico ideal é mostrada a seguir, confira:
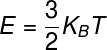
KB – constante de Boltzmann (KB = 1,38.10-23 m².kg/s². K)
Uma vez que a energia térmica dos gases ideais é expressa pela fórmula anterior e representa a energia cinética média do sistema, podemos escrever a seguinte igualdade:
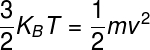
Veja também: Afinal, qual a cor da água?
Usando a fórmula anterior, é possível estimar a velocidade média translacional dos átomos presentes no gás atmosférico. Levando-se em conta uma temperatura de 25 ºC e tomando átomos de oxigênio (M = 16 g/mol), descobrimos uma velocidade média de 680 m/s ou 1525 km/h — essa é a velocidade com que as partículas do gás atmosférico atingem-nos o tempo todo.
No caso dos um gás diatômico, soma-se à expressão usada para os gases monoatômicos o fator ½kBT, em razão do aumento de um grau de liberdade, resultando na seguinte expressão:
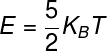
De acordo com a primeira lei da termodinâmica, a energia térmica de um sistema pode ser convertida em outras formas de energia, tais como calor e trabalho. O calor, por exemplo, refere-se à transferência de energia térmica, exclusivamente devido à diferença de temperatura entre um sistema e suas vizinhanças; o trabalho, por sua vez, diz respeito à aplicação de forças sobre o sistema ou pelo sistema.
Nesse sentido, o trabalho pode ser usado para mover um pistão, como acontece nas locomotivas movidas a vapor, e também nos motores de combustão interna, que movem praticamente todos os veículos automotores atuais. A seguir, trazemos a primeira lei da termodinâmica, observe:
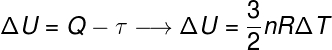
Pela 1ª lei da termodinâmica, a variação da energia interna é a diferença entre trabalho e calor.
Existem outras formas de calcular-se o módulo da energia térmica de um corpo, para o caso de gases ideais, em que se considera nula a energia potencial entre partículas, para tanto expressamos a energia interna em termos do número de mols (n) e também da constante universal dos gases perfeitos (R), confira:
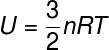
n – número de mols (mol)
R – constante universal dos gases perfeitos (R = 0,082 atm.L/mol.K ou 8,31 J/mol.K)
Ainda no âmbito dos gases perfeitos, combinando-se a equação de Clapeyron (PV = nRT), com a definição de energia exposta, é possível obter uma nova expressão, observe:
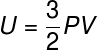
P – pressão (Pa)
V – volume (m³)
Veja também: O ar quente sobe e o ar frio desce, mas por quê?
Vantagens e desvantagens da energia térmica
Cotidianamente, fazemos uso de um grande número de fontes de energia térmica para produzirmos energia. O corpo humano, por exemplo, consome uma grande quantidade de nutrientes para gerar a energia térmica necessária para o funcionamento dos nossos processos vitais. Grande parte da energia elétrica produzida no mundo depende da capacidade de transformarmos energia térmica em eletricidade.
Confira quais são os meios que fazem uso da energia térmica para produzir energia elétrica e as suas principais vantagens e desvantagens:
|
Tipo de usina |
Vantagens |
Desvantagens |
|
Usina termonuclear |
Pouca emissão de gases poluentes e alto rendimento |
Produção de lixo radioativo e exposição à radiação |
|
Usina termoelétrica movida a carvão |
Grande produção de energia e baixo custo |
Emissão de gases poluentes e do efeito estufa |
|
Usina termoelétrica movida a gás natural |
Poluição menor que a da queima do carvão |
Seu custo varia bastante, uma vez que o gás natural é um derivado do petróleo |
|
Usina termoelétrica movida à biomassa |
Baixo custo de instalação e pouca emissão de gases do efeito estufa |
Desmatamento e grandes plantações de monocultura |
|
Usina geotérmica |
Não polui |
Custo de instalação e manutenção elevado |
Veja também: Aprenda hidrostática de uma vez por todas!
Exercícios sobre energia térmica
Questão 1) Dois mols de um gás diatômico ideal encontram-se a temperatura de 127 ºC. A energia térmica desse gás é aproximadamente de:
Dados: R = 8,31 J/mol.K
a)1,5.106 J
b) 1,7.104 J
c) 8,5.103 J
d) 5,3.104 J
e) 8,5.104 J
Gabarito: Letra B
Resolução:
Vamos calcular a energia do gás por meio da expressão seguinte, uma vez que o gás é diatômico, porém, antes de fazê-lo, é necessário converter a temperatura de graus celsius para kelvin, observe o cálculo:
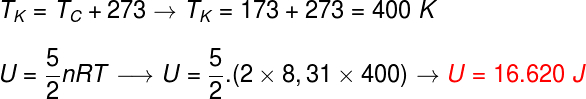
De acordo com os cálculos, esse gás diatômico tem energia de 16.620 J, ou seja, aproximadamente 1,7.104 J, se expresso em notação científica e usando as regras de arredondamento.
Questão 2) Três mols de um gás monoatômico ideal recebem uma quantidade de calor igual a 5.102 cal e realiza um trabalho de 2.102 cal durante o processo. Determine a variação de temperatura sofrida por esse gás, em graus celsius.
Dados: R = 0,082 atm.L/mol.K
a) 214 ºC
b) 813 ºC
c) 1620 ºC
d) 740 ºC
e) 370 ºC
Gabarito: Letra B
Resolução:
Para resolvermos esse exercício, é necessário que combinemos duas fórmulas distintas, a primeira lei da termodinâmica, que determina a variação de energia, e a fórmula da energia térmica do gás monoatômico ideal, observe:
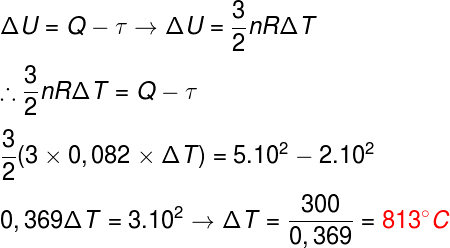
Depois de termos substituído os dados nas fórmulas, encontramos uma variação de 813 ºC, desse modo, a alternativa correta é a letra B.
Por Me. Rafael Helerbrock
