Por muitos anos, a interação entre uma enzima e seu substrato foi descrita pelo modelo “chave-fechadura”. Entretanto, estudos demonstraram que esse mecanismo apresenta falhas, o que levou a um novo modelo: a teoria do encaixe induzido.
Segundo o modelo da chave-fechadura proposto por Emil Fischer em 1894, uma enzima e seu substrato são complementares. As enzimas apresentam uma região específica (sítio ativo) onde o substrato se encaixa. Esse encaixe ocorre em razão das ligações formadas entre o substrato e as cadeias laterais de aminoácidos no sítio ativo. Seria como se cada substrato se encaixasse perfeitamente em uma única enzima, assim como uma chave é usada para abrir uma determinada fechadura (ver figura a seguir).

Observe atentamente o modelo chave-fechadura, no qual o substrato encaixa-se perfeitamente no sítio ativo
De acordo com esse modelo, tanto a enzima como o substrato são fatores rígidos, ou seja, não apresentam flexibilidade e, por isso, as reações enzimáticas apresentam alta especificidade. Porém, estudos comprovam que enzimas apresentam certa flexibilidade, o que viabiliza uma variedade conformacional. Além disso, alguns trabalhos comprovam que o substrato pode induzir tais mudanças.
Diante dessas descobertas, foi proposta a teoria do encaixe induzido (Induced Fit) por Koshland e colaboradores em 1958. De acordo com essa teoria, o substrato é capaz de induzir uma mudança na conformação de uma enzima. Essa modificação pode ser passada para as enzimas próximas, garantindo assim que estas desempenhem seu papel catalítico.
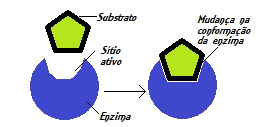
Segundo o modelo do encaixe induzido, o substrato induz mudanças na enzima
A teoria do encaixe induzido sugere, portanto, que a interação entre enzima e substrato não é um processo tão preciso e simples como se imaginava. Entretanto, vale destacar que esse modelo não consegue explicar a grande especificidade observada nas reações enzimáticas.
Por Ma. Vanessa dos Santos


