PUBLICIDADE
O flúor é um halogênio pertencente ao segundo grupo da Tabela Periódica. Quando puro, apresenta-se como um gás diatômico de coloração amarelo-clara e odor característico. O flúor é um elemento extremamente reativo, corrosivo, tóxico e o mais eletronegativo entre todos os elementos da Tabela Periódica.
O flúor é bastante distribuído na crosta terrestre, tendo a fluorita como principal fonte mineral. É obtido por meio da oxidação eletrolítica do fluoreto de potássio e é majoritaramente empregado para a produção do combustível nuclear UF6. Também é usado em cremes dentais e na preparação do teflon, entre outros usos.
Leia também: Césio — o elemento menos eletronegativo da Tabela Periódica
Tópicos deste artigo
- 1 - Resumo sobre o flúor
- 2 - Propriedades do flúor
- 3 - Características do flúor
- 4 - Onde o flúor pode ser encontrado?
- 5 - Obtenção do flúor
- 6 - Aplicações do flúor
- 7 - História do flúor
Resumo sobre o flúor
- O flúor é um ametal localizado no grupo 17 (halogênios) do segundo período da Tabela Periódica.
- Quando puro, apresenta-se como um gás diatômico, de odor característico e coloração amarelo-clara.
- É muito tóxico, reativo, corrosivo e é também o elemento mais eletronegativo de toda Tabela Periódica.
- É abundante na crosta terrestre, sendo o 13º elemento mais frequente. Sua principal fonte mineral é a fluorita (CaF2).
- Sua forma de obtenção se dá por meio da oxidação eletrolítica do fluoreto de potássio em fluoreto de hidrogênio anidro.
- É principalmente usado na produção do combustível nuclear UF6, mas também é importante para a saúde bucal (contenção de cáries), na produção do teflon, entre outros.
- Foi descoberto, em 1886, pelo cientista francês Henri Moisson, o qual recebeu, em 1906, um prêmio Nobel de Química por tais trabalhos.
Propriedades do flúor
- Símbolo: F
- Número atômico: 9
- Massa atômica: 18,998 u.m.a
- Eletronegatividade: 3,98
- Ponto de fusão: -219,67 °C
- Ponto de ebulição: -188,12 °C
- Densidade: 1,696 g.L-1 (0 °C, 1 atm)
- Configuração eletrônica: [He] 2s2 2p5
- Série química: ametais, halogênios, grupo 17, elementos de representativos.
Características do flúor
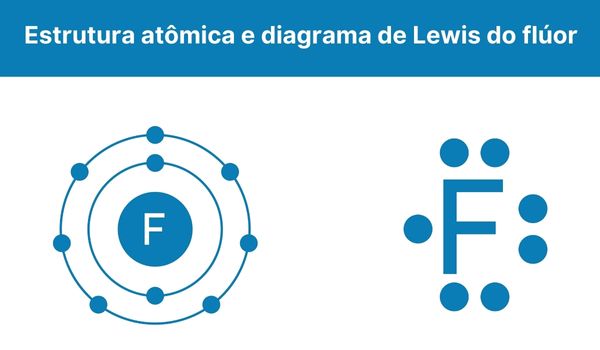
O flúor é um elemento ametálico, localizado no grupo 17 do segundo período da Tabela Periódica. Em sua forma pura, ele é um composto diatômico de fórmula F2, apresentando-se como um gás de coloração amarelo-clara, com um odor doce, quase prazeroso, similar ao O3 ou ao Cl2, e que pode ser detectado facilmente em concentrações acima de 1 ppm. Em sua forma líquida, tem uma coloração amarelo alaranjada.
É extremamente corrosivo e, não à toa, é o agente oxidante mais forte entre todos os elementos, sendo também o elemento mais reativo que se conhece.
O flúor é altamente tóxico e é bem perigoso de ser manuseado em grandes concentrações, por isso, são necessárias adoção de técnicas e precauções devidas, como a utilização de equipamentos de aço ou de teflon.
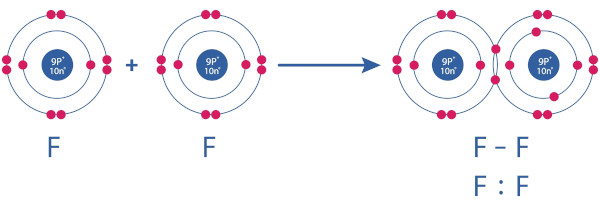
O flúor reage com todos os elementos em altas concentrações, com exceção de O2, N2, He, Ar e Kr. Tais reações são muito exotérmicas e tendem a ser bem violentas. A grande reatividade do flúor é consequência da baixa energia de dissociação da ligação F–F e da grande força da ligação da substância formada após a reação. A ligação do F2 é fraca como uma consequência da repulsão dos pares de elétrons não ligantes (cada átomo de flúor tem três pares após o estabelecimento da ligação covalente), os quais estão muito próximos quando a ligação F–F é formada.
O flúor é ainda o elemento mais eletronegativo de toda a Tabela Periódica. Por conta disso, ele nunca será encontrado em um estado de oxidação positivo e, assim, sempre adquire a carga -1 na formação de compostos.
Onde o flúor pode ser encontrado?

O flúor é amplamente distribuído na natureza, representando 0,065% da massa da crosta terrestre e, assim, obtendo o posto de 13º elemento mais abundante na crosta terrestre, na frente de elementos como o cloro e metais comuns, tais como zinco e cobre. As principais fontes naturais de flúor são a fluorita (CaF2), criolita (Na3AlF6) e fluorapatita (Ca5F(PO4)3). A fluorapatita, aliás, é um caso comum de substituição de hidróxido (OH) por flúor em minerais.
Veja também: Ferro — o quarto elemento mais abundante na crosta terrestre
Obtenção do flúor
O flúor é produzido pela eletrólise de fluoretos fundidos, tais como o KF. Essa técnica ainda é muito semelhante à forma como ele foi isolado, por Henri Moissan, em 1886.
Para a obtenção, o flúor deve ser oxidado de F- para F2. Nessa eletrólise, não se pode utilizar eletrólitos aquosos, considerando-se que a água, diante do flúor, seria oxidada, além do fato de qualquer flúor produzido reagir imediatamente com a própria água.
Assim, utiliza-se a oxidação eletrolítica, com o fluoreto de potássio em fluoreto de hidrogênio anidro (KF∙2HF) e utilizando ânodos de carbono e cátodos de aço ou cobre. Um aparato também é montado para prevenir que o hidrogênio formado no cátodo se encontre com o flúor formado no ânodo.
Aplicações do flúor
Boa parte do flúor produzido é utilizada pela indústria de combustíveis nuclear, na produção do UF6, e pela indústria elétrica, na produção do SF6, empregado na fabricação do meio dielétrico em dispositivos elétricos.
O fluoreto de hidrogênio, HF, é bastante empregado para a obtenção de diversos fluoretos metálicos. Alguns, nos quais os metais possuem alto número de oxidação, são empregados como oxidantes fortes, tais como AuF5, AgF3 e NiF4.
O flúor também deu início à química dos gases nobres (elementos pertencentes ao grupo 18 da Tabela Periódica) quando Neil Bartlett, em 1962, mostrou a síntese do fluoreto de xenônio. Hoje existem fluoretos não só de xenônio mas também de criptônio e radônio.
O flúor substitui muito bem o hidrogênio e o oxigênio em compostos orgânicos, dado seu pequeno átomo e comportamento covalente, dando origem a diversos compostos com uma ligação C–F estável. O maior exemplo da aplicação do flúor na química orgânica é o polímero conhecido como Teflon (politetrafluoretileno), usado em panelas antiaderentes.

Os compostos orgânicos com flúor também têm sido empregados na indústria farmacêutica. Sua alta eletronegatividade e a estabilidade da ligação C–F são muito bem-vistas, não sendo possível a liberação de fluoretos tóxicos para o organismo. Não à toa, cerca de 20% dos produtos farmacêuticos atuais possui flúor em sua composição.
Os cloroflúorcarbonos (CFCs) foram amplamente usados como líquidos refrigerantes e em aerosóis, porém tiveram seu uso desestimulado, devido ao fato de serem capazes de consumir o ozônio estratosférico, dando origem ao problema conhecido como o buraco na camada de ozônio.
Em 1958, a Organização Mundial da Saúde (OMS) reconheceu a importância da fluoretação da água como forma de combate ao surto de cáries na população. No Brasil, tal prática se iniciou em 31 de outubro de 1953, em Baixo Guandu, Espírito Santo, por meio da utilização do fluossilicato de sódio.
Alguns estudos realizados no Brasil demonstraram que, após 14 anos, a prática reduziu em 65% a incidência de cárie em crianças de 6 a 12 anos dessa cidade. A confirmação da prática como ideal para a saúde pública se deu, em 1982, por meio da Conferência sobre Fluoretos, organizada pela OMS, pela Federação Dentária Internacional e pela Fundação Kellogg.
A eficiência do flúor contra cáries também o fez figurar na composição química de cremes dentais, com base nos compostos fluoreto de sódio e monofluorfosfato de sódio. Na Alemanha, França e Suíça, também é comum a fluoretação do sal de cozinha para conter o surto de cáries.
História do flúor
O nome flúor deriva do mineral fluorita, CaF2, a qual era usada como fundente (ou fluxo) na indústria metalúrgica, desde 1529, por meio dos trabalhos de Georgius Agricola. No começo do século XVII, percebeu-se que a fluorita, quando aquecida, era capaz de emitir luz, dando origem ao fenômeno da fluorescência.
Mesmo com a fluorita e com outros fluoretos sendo empregados pela sociedade, a natureza elementar do flúor não foi conhecida até o século XIX. Depois que Humphry Davy descobriu o cloro, em 1810, André-Marie Ampère propôs que o ácido formado da fluorita com o ácido sulfúrico era semelhante ao ácido clorídrico. Pelos 70 anos seguintes, diversos químicos tentaram isolar o elemento flúor, mas seus esforços se mostravam em vão por conta da alta reatividade do elemento.
Até que, em 1886, o químico francês Henri Moissan foi o responsável pela descoberta do elemento. Ele realizou a eletrólise de uma solução de KHF2 em HF anidro e obteve um gás que fez um silício cristalino explodir em chamas. Não demorou muito para Moissan reportar suas descobertas para a Academia Francesa de Ciências. Posteriormente, pela descoberta do flúor, o cientista foi agraciado com o Prêmio Nobel de Química de 1906.
Por Stéfano Araújo Novais
Professor de Química







