PUBLICIDADE
As reações orgânicas de eliminação são aquelas em que átomos ou grupos de átomos de uma molécula são retirados ou eliminados dela, criando-se um novo composto orgânico, além de um composto inorgânico que é formado pela parte que foi eliminada.
Um tipo de reação de eliminação é a desidratação, na qual a molécula que se perde é a da água. A desidratação dos álcoois (compostos que possuem o grupo OH ligado a um carbono saturado numa cadeia aberta) pode se dar de duas formas: intramolecular e intermolecular.
“Intra” significa “dentro”, portanto, a desidratação intramolecular dos álcoois ocorre quando há a saída de uma molécula de água de “dentro” da própria molécula de álcool. Nesse caso, o produto orgânico formado será um alceno.
Essa reação se processa apenas na presença de um catalisador que atua como desidratante, sendo que na maioria das vezes é o ácido sulfúrico concentrado (H2SO4) e a temperatura deve estar em torno de 170ºC.
Exemplo:
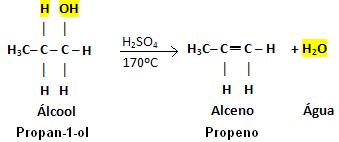
Observe que saiu o grupo OH e no carbono vizinho saiu o hidrogênio, originando a água. Além disso, criou-se a ligação dupla que originou o alceno.
A facilidade para sofrer desidratação segue a seguinte ordem decrescente:
Álcoois terciários > Álcoois secundários > Álcoois primários
Mas, e quando o grupo OH vem no meio da cadeia carbônica? O átomo de hidrogênio de qual átomo de carbono vizinho será liberado e formará a molécula de água?
Por exemplo, a seguir, temos o 2-metilpentan-3-ol. Observe que um átomo de carbono vizinho é terciário (destacado em vermelho), enquanto que o outro é secundário (destacado em azul):
H OH H
│ │ │
H3C─ C ─ C ─ C ─ CH3
│ │ │
H H CH3
O hidrogênio ligado ao átomo de carbono terciário terá maior facilidade para sair, porque o seu caráter eletronegativo é igual a δ+1, assim, quanto menos negativo estiver o caráter do carbono, mais fraca será a ligação entre eles e mais fácil será para romper sua ligação.
Em casos como esse, todos os compostos possíveis são formados, porém, a predominância será dada pela ordem: Álcoois terciários > Álcoois secundários > Álcoois primários.
Assim, temos:
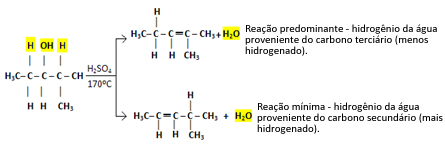
Esse tipo de reação obedece à regra de Saytzef, que diz que haverá maior tendência do hidrogênio sair do carbono menos hidrogenado. Essa regra é exatamente o contrário da Regra de Markovnikov usada para reações de adição.
Para complementar seus conhecimentos nesse assunto, leia também o texto “Desidratação Intermolecular dos Álcoois”.
Por Jennifer Fogaça
Graduada em Química






