As reações de nitração são reações de substituição que ocorrem por meio do ácido nítrico (HNO3). Esse tipo de reação ocorre especialmente com alcanos e com o benzeno e seus derivados, onde um dos átomos de hidrogênio ligados à cadeia ou ao núcleo aromático é substituído pelo grupo NO2, originando um nitrocomposto e água.
Veja alguns exemplos:
1. Nitração de um alcano:
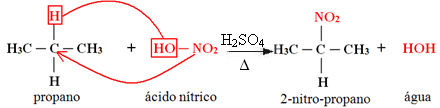
Quando o alcano possui mais de dois carbonos, forma-se uma mistura de compostos diferentes substituídos. A quantidade de cada composto obtido será proporcional à seguinte ordem de facilidade com que o hidrogênio é liberado na molécula:
.jpg)
No caso acima, não há carbono terciário, existe apenas um secundário e dois primários; assim, a maior quantidade de composto formado como produto será o 2-nitro-propano.
Se houver ácido nítrico suficiente, outro hidrogênio pode ser substituído pelo grupo nitro, dando origem ao 2-dinitropropano (estrutura abaixo), um composto muito utilizado como aditivo para o óleo diesel, aumentando sua octanagem e diminuindo a emissão de fuligem.
NO2
│
H3C ─ C ─ CH3
│
NO2
2. Nitração do benzeno:
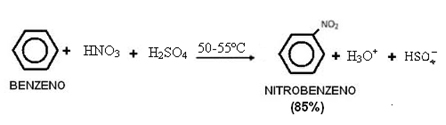
Observe que essa reação ocorre com a presença de calor, pois se aquece o benzeno com uma mistura sulfonídrica, ou seja, de ácido nítrico concentrado com ácido sulfúrico concentrado. O ácido sulfúrico é um catalisador, fazendo com que a velocidade da reação aumente, visto que o benzeno reage lentamente com o ácido nítrico.
3. Nitração de derivados do benzeno:
Nesses casos o local da substituição irá depender do grupo substituinte ou grupo funcional ligado ao núcleo aromático. Os textos “Radicais Dirigentes no Anel Benzênico” e “Efeitos eletrônicos de radicais meta e orto-para-dirigentes” explicam melhor sobre como isso ocorre.
Anéis aromáticos podem sofrer nitração e dar origem a explosivos. Um exemplo é o trinitrotolueno (2-metil-1,3,5-trinitrobenzeno), mais conhecido como TNT e há vários pigmentos utilizados principalmente em tecidos.
.jpg)
Por Jennifer Fogaça
Graduada em Química