O rutherfórdio é um elemento sintético de número atômico 104, pertencente ao grupo 4 da Tabela Periódica, sendo o primeiro elemento da série dos transactinídeos. Sua primeira detecção data de 1964, nos famosos laboratórios da cidade de Dubna. Assim como demais transactinídeos, o nome oficial do elemento 104 esteve envolvido em um conflito entre soviéticos e americanos, em um pedaço da Guerra Fria na história da Química.
O rutherfórdio não tem aplicações práticas, dado que seu isótopo mais estável tem cerca de duas horas e meia de tempo de meia-vida. Contudo, estudos em sistemas gasosos e em soluções comprovam sua similaridade química com os demais elementos do grupo 4, como zircônio e háfnio.
Leia também: Seabórgio — elemento sintético cujo nome homenageia o cientista Glenn Seaborg
Tópicos deste artigo
- 1 - Resumo sobre o rutherfórdio
- 2 - Propriedades do rutherfórdio
- 3 - Características do rutherfórdio
- 4 - Obtenção do rutherfórdio
- 5 - Precauções com o rutherfórdio
- 6 - História do rutherfórdio
- 7 - Exercícios resolvidos sobre rutherfórdio
Resumo sobre o rutherfórdio
- É um elemento químico sintético localizado no grupo 4 da Tabela Periódica.
- Foi sintetizado pela primeira vez em 1964, no Joint Institute for Nuclear Research, em Dubna, Rússia.
- É um elemento radioativo.
- Assim como outros transactinídeos, o rutherfórdio sofre com a baixa estabilidade e há dificuldade de se sintetizar amostras consideráveis para estudos.
- Seu nome foi oficializado apenas em 1997, depois de vários anos de disputa entre americanos e soviéticos.
Propriedades do rutherfórdio
- Símbolo: Rf
- Número atômico: 104
- Massa atômica: 267 u.m.a
- Configuração eletrônica: 7s2 5f14 6d2
- Isótopo mais estável: 267Rf (2,5 ± 1,5 horas de meia-vida)
- Série química: grupo 4, transactinídeos, elementos superpesados
Características do rutherfórdio
Como todos os transactinídeos, ou seja, elementos logo após o laurêncio (Lr), o rutherfórdio é um elemento radioativo. Seu isótopo mais estável foi detectado em 2004 e seu tempo de meia-vida (o tempo necessário para a quantidade do radioisótopo cair pela metade) é de duas horas e meia, com margem de erro de uma hora e meia, para mais ou para menos.
A grande dificuldade de se estabelecer as características químicas do rutherfórdio e outros elementos transactinídeos é, de maneira geral, o fato de haver baixa taxa de produção, seja em quantidade, seja em velocidade. Nesses elementos, por exemplo, é muito comum se avaliar quimicamente apenas um único átomo, o que, de certa forma, necessita de adaptações em termos de cálculos, pois boa parte das equações são estabelecidas para sistemas com mais de um átomo. Além disso, muitas vezes os isótopos têm tempos de meia-vida muito curtos, o que dificulta ou até mesmo inviabiliza estudos mais aprofundados.
No caso específico do Rf, cientistas já conseguiram provar que seu comportamento em fase líquida se assemelha aos dos demais elementos mais leves do grupo 4, zircônio e háfnio, como na formação de fluoretos em solução com conseguinte extração em resinas de troca iônica. Esse comportamento ajudou a solidificar a presença do rutherfórdio no grupo 4 da Tabela Periódica.
Leia também: Novos elementos químicos — os quatro elementos que faltavam no 7º período
Obtenção do rutherfórdio
Transactinídeos necessitam de grande infraestrutura para sua produção. Todos são sintetizados com aceleradores de partículas, em que espécies iônicas colidem com elementos pesados. A detecção desses elementos também não é simples e direta.
Quando formado, o elemento radioativo, por sua natureza, começa a decair e apresentar emissões, como partículas alfa e beta. Muitas vezes é preciso avaliar o decaimento radioativo do átomo formado ou até mesmo identificar espécies atômicas que possam surgir dessas reações nucleares, como em um quebra-cabeça.
Some isso ao fato de que os tempos de meia-vida dos isótopos de transactinídeos costumam ser curtos, na faixa de segundos, fazendo com que só seja possível obter uma quantidade na faixa de poucos átomos ou, até mesmo, um único átomo.
No caso do Rf, a primeira síntese reportada para esse elemento envolvia a colisão de isótopos de plutônio, Pu, com íons do isótopo 22 do neônio, Ne.
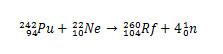
Contudo, outros isótopos do rutherfórdio podem ser produzidos modificando-se as espécies que colidirão. Por exemplo, o isótopo 261 pode ser produzido pela reação entre o oxigênio-18 e o cúrio-248, com produção de cinco nêutrons.
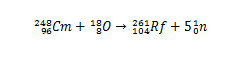
Confira no nosso podcast: Como funciona um acelerador de partículas?
Precauções com o rutherfórdio
Uma vez que o rutherfórdio sequer consegue ser produzido em uma escala considerável, os riscos associados a esse elemento estão ligados aos efeitos da radiação. Contudo, em um laboratório controlado, esses riscos são previstos e, assim, minimizados.
História do rutherfórdio

Todos os transactinídeos estiveram envolvidos em uma corrida por sua descoberta nos anos 1960 e 1970. Tal episódio é relatado como a Guerra dos Transférmios, um pedaço da Guerra Fria na história da Química. Apesar de ser chamada assim, o que dá a entender que as disputas ocorriam por elementos após o férmio, elemento de número atômico 100, os elementos diretamente envolvidos foram do 104 ao 109, os recém-descobertos transactinídeos.
No caso do rutherfórdio, a disputa se iniciou em 1964, quando os pesquisadores soviéticos do Joint Institute for Nuclear Research, na cidade de Dubna, Rússia, reportaram a descoberta do isótopo 260 do elemento 104 ao bombardearem plutônio-242 com íons neônio-22. Porém os pesquisadores de Dubna apenas apresentaram uma evidência, que foi a detecção de um isótopo que sofreu decaimento espontaneamente, sem identificar com clareza sua massa e seu tempo de meia-vida. Com isso, a descoberta foi vista com desconfiança.
Cinco anos depois, em 1969, o time dos cientistas norte-americanos do Lawrence Berkeley National Laboratory, em Berkeley, Califórnia, liderado por Albert Ghiorso, disse prover evidências suficientes para a descoberta do isótopo 257 do elemento 104 ao se fazer colidir o califórnio-249 com o carbono-12. Os mesmos cientistas conseguiram, posteriormente, produzir o isótopo 259 do elemento 104. Em 1973, cientistas do Oak Ridge National Laboratory, de forma independente, confirmaram o número atômico 104 para o isótopo de massa 257 produzido em Berkeley.
Os anos seguintes foram de grande disputa entre os cientistas dos dois países, até que, em 1985, a União Internacional de Química Pura e Aplica (Iupac) e a União Internacional de Física Pura e Aplicada (Iupap) decidiram formar uma comissão mista de nove cientistas, chamada de Grupo de Trabalho dos Transférmios (Transfermium Working Group ou TWG). O TWG foi criado para decidir sobre quem de fato era o responsável pelas descobertas dos elementos que iam do 101 até o 112.
Mesmo assim, as decisões do TWG nem sempre foram isentas de questionamento. No caso do elemento 104, o grupo de trabalho decidiu que o crédito deveria ser dividido entre os cientistas soviéticos e norte-americanos, algo que não agradou em nada aos cientistas de Berkeley.
Em 1991, Ghiorso e Seaborg, do time de Berkeley, chegaram a afirmar que a identificação do elemento 104 pelos cientistas de Dubna era claramente errada e, em dado momento, negaram a validade das conclusões do TWG, considerando-as um desserviço para a comunidade científica.
Não à toa, no começo dos anos 1990, os nomes para os novos elementos ainda não eram um consenso. Houve então negociações envolvendo cientistas alemães, russos e norte-americanos, as quais se mostraram frustradas. Nisso, em 1992, o laboratório alemão Gesellschaft für Schwerionenforschung (GSI) propôs nomes para os elementos 102 até 109, colocando meitnério para o elemento 104.
Mesmo assim, a lista, apesar de ter sido elogiada, não foi aceita pelos cientistas envolvidos. A decisão poderia ser tomada em 1994, durante a conferência da Comissão de Nomenclatura de Compostos Inorgânicos (em inglês, CNIC) da Iupac. Nela, optou-se pelo nome dúbnio para o elemento 104, contudo, a American Chemical Society adotou, no mesmo ano, o nome rutherfórdio para o elemento 104, em um momento de descrédito por parte dos americanos, que chegaram a questionar a autoridade da Iupac em oficializar novos nomes.
Apenas em 1997, na conferência geral da Iupac, em Genebra, é que o elemento 104 foi enfim oficializado como rutherfórdio, após a ACS ceder na nomenclatura de outros elementos próximos.
Exercícios resolvidos sobre rutherfórdio
Questão 1
O rutherfórdio é um elemento sintético e uma das principais dificuldades em estudá-lo é o fato de não ser possível sintetizar grandes quantidades dele.
Entre os fatores possíveis que contribuem para essa dificuldade, podemos indicar:
(A) O rutherfórdio tem isótopos de longo tempo de meia-vida, da ordem de milhões de anos.
(B) O rutherfórdio decai espontânea e muito rapidamente, impedindo a detecção de suas quantidades macroscópicas.
(C) Não existem tecnologias capazes de sintetizar o rutherfórdio, sendo seus dados estritamente teóricos e sem fundamento científico.
(D) As leis da química afirmam ser impossível sintetizar elementos cujo número atômico supere o do laurêncio, 103.
(E) Durante a síntese do rutherfórdio, elementos mais leves do seu grupo são priorizados quimicamente.
Resposta: letra B
Elementos transactinídeos, como o Rf, são radioativos e sofrem decaimento espontâneo em grande velocidade, uma vez que o tempo de meia-vida é curto. Dessa forma, ao término do experimento, poucos são os átomos que restam da espécie sintética.
Questão 2
Em 1964, pesquisadores de Dubna afirmaram terem sintetizado o isótopo-260 do rutherfórdio (Z = 104). No caso desse isótopo, qual o número de nêutrons?
(A) 104
(B) 260
(C) 151
(D) 156
(E) 161
Resposta: letra D
O número de nêutrons (n) pode ser calculado, utilizando-se o número de massa (A) e o número atômico (Z), por meio da seguinte equação:
A = Z + n
Substituindo, temos:
260 = 104 + n
n = 260 – 104
n = 156
Créditos da imagem
Por Stéfano Araújo Novais
Professor de Química

