Reações de sulfonação em alcanos são reações orgânicas de substituição, realizadas com o objetivo de produzir ácidos sulfônicos (compostos orgânicos que apresentam o grupo SO3H ligado a um átomo de carbono ou a uma cadeia carbônica) e água (H2O).
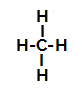
![]()
Fórmula estrutural de um ácido sulfônico
Para a realização de uma reação de sulfonação em alcanos, devemos misturar um alcano (composto formado por uma cadeia carbônica saturada com apenas átomos de carbono e hidrogênio) e o ácido sulfúrico (H2SO4) concentrado, submetidos a aquecimento (∆).
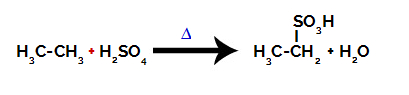
Equação química representando a sulfonação de um alcano de dois carbonos
Princípios da reação de sulfonação em alcanos
Como a reação de sulfonação em alcano é uma reação de substituição, temos nela uma troca entre componentes de menor eletronegatividade dos reagentes, ou seja, entre o alcano e o ácido sulfúrico. O alcano apresenta o hidrogênio, e o ácido sulfúrico, o grupo sulfônico.
Abaixo, temos o passo a passo do mecanismo de uma reação de sulfonação em alcanos. Para exemplificar, utilizaremos o alcano mais simples, o metano (CH4):
-
1º Passo: Rompimento da ligação entre a hidroxila (OH) e o enxofre (S) no ácido sulfúrico.
Cada grupo hidroxila presente no ácido sulfúrico tem por característica ser mais eletronegativo. Com o aquecimento durante a reação, a tendência é que a ligação entre o grupo hidroxila e o enxofre seja rompida:
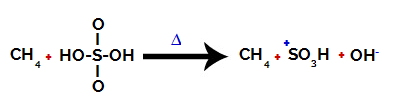
Rompimento da ligação entre o enxofre e a hidroxila
No entanto, não ocorre o rompimento da ligação de todas as hidroxilas por causa do rearranjo eletrônico na estrutura. Obtém-se, então, um ânion hidróxido (OH-) e um cátion sulfônico.
-
2º Passo: Ataque do grupo hidroxila à molécula do alcano.
Não pare agora... Tem mais depois da publicidade ;)
Em seguida, o grupo hidróxido (OH-) realiza um ataque ao alcano, fazendo com que a ligação entre carbono e hidrogênio (que é mais frágil por causa da diferença de eletronegatividade entre eles) seja rompida.
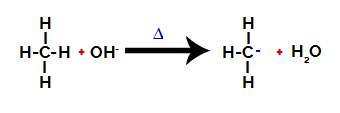
Rompimento da ligação entre o carbono e o hidrogênio no alcano
Obs.: O rompimento da ligação entre o carbono e o hidrogênio sempre ocorrerá com maior freqüência no carbono de menor densidade eletrônica ou carga. Quanto menos hidrogênios o carbono tiver, ou quanto mais grupos ligados a ele, menor sua densidade eletrônica. Assim, temos:
Carbono terciário < Carbono secundário < Carbono primário
Após o rompimento da ligação, o alcano passa a apresentar um carbono deficiente em elétrons (carbocátion). Já o grupo hidróxido (OH-) interage com o hidrogênio liberado e forma uma molécula de água.
-
3º Passo: Ataque do radical formado ao grupo sulfônico.
Não pare agora... Tem mais depois da publicidade ;)
Por fim, o grupo sulfônico é atacado pelo restante do alcano, formando um ácido sulfônico.
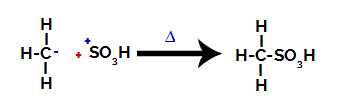
Estruturas que interagem e formam o ácido sulfônico
Exemplos de equações que representam reações de sulfonação em alcanos
1º Exemplo: Sulfonação do propano.
O propano apresenta dois carbonos primários e um carbono secundário, os quais apresentam cargas diferentes por estarem ligados a quantidades diferentes de hidrogênios. Como o carbono é mais eletronegativo que o hidrogênio, esses carbonos apresentam densidades eletrônicas diferentes.
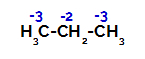
Distribuição das cargas em cada átomo de carbono do propano
Nos carbonos primários, a carga é igual a -3 (por estar ligado a três hidrogênios), e, no carbono secundário, a carga é igual a -2 (por estar ligado a dois hidrogênios). Assim, haverá o rompimento da ligação entre carbono e hidrogênio ora no carbono 1 (de uma molécula), ora no carbono 2 (de outra molécula).
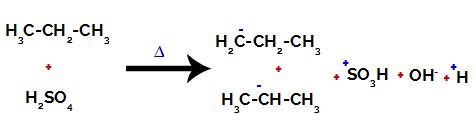
Rompimento da ligação entre carbono e hidrogênio em carbonos diferentes
Após os rompimentos entre as ligações, tanto no ácido sulfúrico quanto no alcano, há a formação dos produtos com a substituição do hidrogênio no carbono 1 por grupo sulfônico, e o mesmo ocorre no carbono 2.
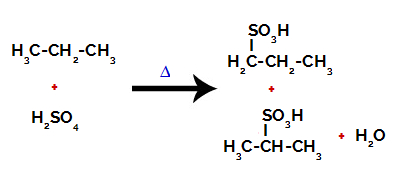
Produtos formados a partir da sulfonação do propano
-
2º Exemplo : Sulfonação do 2-metil-butano.
Não pare agora... Tem mais depois da publicidade ;)
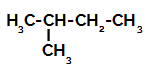
Fórmula estrutural do 2-metil-butano
O 2-metil-butano apresenta três carbonos primários, um carbono secundário e um carbono terciário, os quais apresentam cargas diferentes e, consequentemente, densidades eletrônicas diferentes, como podemos observar na estrutura a seguir:
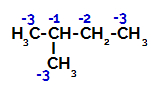
Distribuição das cargas eletrônicas no 2-metil-butano
Por isso, há no 2-metil-butano várias possibilidades de rompimento da ligação entre carbono e hidrogênio, que pode ocorrer no carbono 1 (de uma molécula), no carbono 2 (de outra molécula), no carbono 3 ou no carbono 4. Porém, vale ressaltar que o rompimento no carbono de número 2 é mais comum.
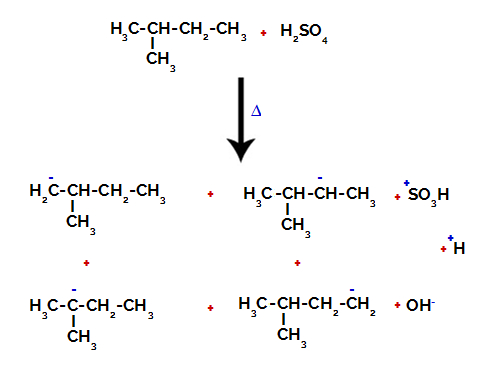
Rompimento da ligação entre carbono e hidrogênio em carbonos diferentes
Após os rompimentos entre as ligações, tanto no ácido sulfúrico quanto no alcano, ocorre a formação dos produtos com a substituição do hidrogênio no carbono 1 por um grupo sulfônico, e o mesmo acontece no carbono 2.
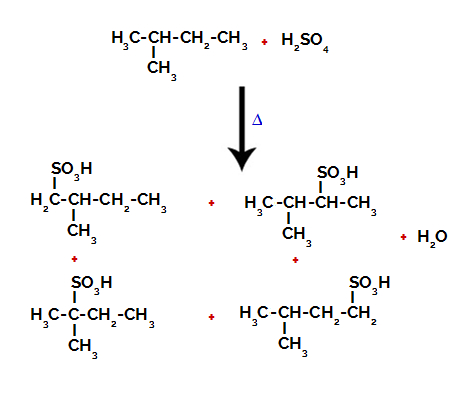
Produtos formados a partir da sulfonação do 2-metil-butano
Por Me. Diogo Lopes Dias