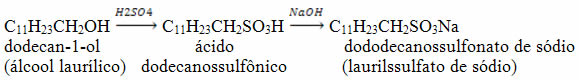Os ácidos sulfônicos são uma classe de compostos orgânicos caracterizada pelo grupo funcional abaixo:
R ─ SO3H
Grupo funcional (ácido sulfônico)
“R” corresponde a qualquer radical derivado de um hidrocarboneto.
Tópicos deste artigo
Obtenção do ácido sulfônico
Os ácidos sulfônicos podem ser obtidos por meio de uma reação entre um hidrocarboneto e o ácido sulfúrico, na qual um hidrogênio do hidrocarboneto acaba sendo substituído pelo ácido sulfônico e gerando também água como subproduto:
R─H + HO ─ SO3H → R─ SO3H + H2O
hidrocarboneto ácido sulfúrico ácido sulfônico água
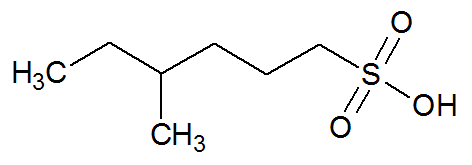
Essa consideração do grupo ─ SO3H como substituto de um hidrogênio em um hidrocarboneto dá origem à nomenclatura proposta para esses compostos, que é dada pelas seguintes regras:

Assim, temos os exemplos:
H3C6 ─ 5CH2 ─ 4CH ─ 3CH ─ 2CH2─ 1CH3 : ácido 4-metilhexano-3-sulfônico
│ │
CH3 SO3H
CH3 ─SO3H: ácido metanossulfônico
CH3 ─ CH2─SO3H: ácido etanossulfônico
Para que serve o ácido sulfônico?
Os ácidos sulfônicos são mais conhecidos pela sua aplicação na obtenção de espumantes, que estão presentes em xampus, detergentes e cremes dentais. Esses sais agem como agentes surfactantes, ou seja, agem diminuindo a tensão superficial. O nome genérico para essa classe de compostos é ‘agentes tensoativos’.Nos dentes, por exemplo, isso é importante porque permite a penetração nas fissuras e auxilia na remoção dos detritos da superfície do esmalte. O espumante mais comum empregado em pastas dentais é o sulfato de sódio e laurila (H3C[CH2]10CH2OSO3Na).
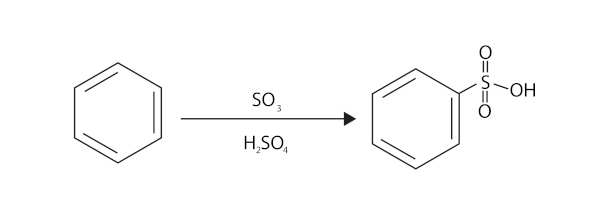
Os detergentes sintéticos usados como substitutos dos sabões reduzem a tensão superficial da água e então permitem que os óleos e gorduras sejam emulsionados. No Brasil, os detergentes sintéticos aniônicos costumam conter o alquilbenzeno- sulfonatos de sódio, de cadeia linear:
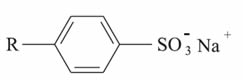
Outro muito usado também é o lauril sulfonato de sódio, que é um sal obtido pela reação descrita a seguir, entre um ácido sulfônico e o hidróxido de sódio:
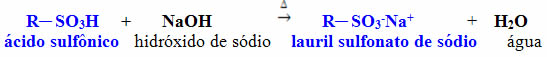
Outro exemplo de obtenção de um composto com propriedades detergentes é o dododecanossulfonato de sódio que é obtido pela reação abaixo, a partir do dodecan-1-ol: