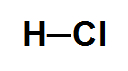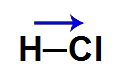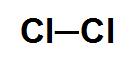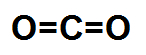Moléculas inorgânicas apolares são aquelas que apresentam um vetor momento dipolar resultante igual a zero, ou seja, não apresentam polos positivos e negativos.
O vetor momento dipolar é a representação do sentido de atração dos elétrons da ligação entre dois átomos, que apresentem diferença de eletronegatividade:
No HCl, o cloro é mais eletronegativo que o hidrogênio, logo o vetor momento dipolar é direcionado para o cloro. O cloro é o polo negativo, e o hidrogênio é o polo positivo, por isso, essa molécula é considerada polar.
No entanto, no caso das moléculas inorgânicas apolares isso não acontece. Para entender essa diferença, demonstraremos a formação desse tipo de molécula com alguns exemplos neste texto. Vale ressaltar que a análise da polaridade é dependente da geometria da molécula, além da diferença de eletronegatividade.
1º Exemplo: Gás cloro (Cl2)
Nessa molécula de geometria linear, há a interação entre dois átomos de um mesmo elemento químico, ou seja, que apresentam a mesma eletronegatividade. Assim, nenhum deles atrai para perto de si os elétrons da ligação, não apresentando vetores momento dipolares. Por causa disso, a molécula não possui polos, sendo então apolar.
2º Exemplo: Dióxido de carbono (CO2)
Nessa molécula de geometria linear, um átomo de carbono está ligado a dois átomos de oxigênio, e o oxigênio é mais eletronegativo que o carbono. Em razão disso, existe um vetor momento dipolar direcionado para cada um dos oxigênios.
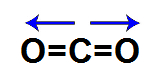
Vetores momento dipolar no CO2
Como os vetores estão em direções opostas, eles anulam-se. Assim, o vetor momento dipolar resultante da molécula será igual a 0. Isso significa que essa é uma molécula inorgânica apolar.
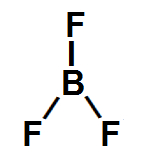
3º Exemplo: Trifluoreto de boro (BF3)
Nessa molécula de geometria trigonal plana, há um átomo de boro ligado a três átomos de flúor, sendo o flúor mais eletronegativo que o boro. Por isso, existe um vetor momento dipolar direcionado do boro para cada um dos átomos de flúor.
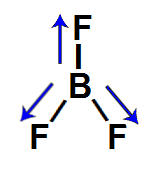
Vetores momento dipolar no BF3
Assim, dois vetores (de mesma direção) estão no sentido diagonal, e um está no sentido vertical para baixo. De acordo com a regra do paralelogramo, os dois vetores diagonais são decompostos para formar apenas um vetor, mantendo-se a direção.
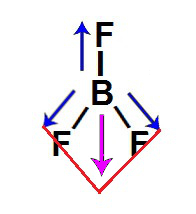
Decomposição dos vetores na molécula do BF3
Por fim, haverá apenas dois vetores nessa molécula, de mesmo sentido (vertical), porém em direções opostas, que se anulam. O vetor momento dipolar resultante, portanto, será igual a 0, o que significa que essa é uma molécula inorgânica apolar.
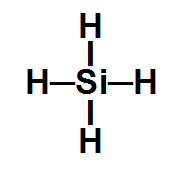
4º Exemplo: Tetra-hidreto de silício (SiH4)
Nessa molécula de geometria tetraédrica, um átomo de silício está ligado a quatro átomos de hidrogênio, sendo o hidrogênio mais eletronegativo que o silício. Em razão disso, existe um vetor momento dipolar direcionado do silício para cada um dos hidrogênios.
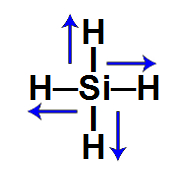
Vetores momento dipolar no SiH4
Dessa forma, há dois vetores (de direções opostas) no sentido horizontal, os quais se anulam, e dois vetores no sentido vertical (de direções opostas), que também se anulam. Assim, o vetor momento dipolar resultante será igual a 0, o que significa que essa é uma molécula inorgânica apolar.
Por Me. Diogo Lopes Dias