O efeito fotoelétrico é um fenômeno físico que consiste na emissão de elétrons por certos materiais, geralmente metálicos, quando iluminados por ondas eletromagnéticas de frequências específicas. Nesse fenômeno, a luz comporta-se como uma partícula, transferindo energia para os elétrons, que são ejetados para fora do material.
Tópicos deste artigo
- 1 - Resumo sobre efeito fotoelétrico
- 2 - História do efeito fotoelétrico
- 3 - Fórmulas
- 4 - Tabela de função trabalho
- 5 - Experimento do efeito fotoelétrico
- 6 - Elétron-Volt
- 7 - Aplicações tecnológicas do efeito fotoelétrico
- 8 - Exercícios resolvidos
Resumo sobre efeito fotoelétrico
-
Fenômeno físico descoberto por Heinrich Hertz, em 1886;
-
Explicado por Albert Einstein, em 1905, por meio da quantização da luz proposta por Planck em 1900;
-
Os elétrons só são ejetados caso a energia dos fótons incidentes seja maior ou igual à função trabalho do material;
-
A energia cinética dos elétrons ejetados só depende da frequência da luz incidente;
-
A intensidade da luz só afeta a quantidade de elétrons que é ejetada a cada segundo.
História do efeito fotoelétrico
Por volta de 1886, o físico alemão Heinrich Hertz (1857-1894) realizava diversos experimentos com o intuito de demonstrar a existência das ondas eletromagnéticas. Para tanto, Hertz produzia descargas entre dois eletrodos, e, em certas ocasiões, ele percebeu que, quando iluminado, o cátodo era capaz de produzir descargas elétricas mais intensas. Sem saber, Hertz havia descoberto o efeito fotoelétrico, por meio das emissões de raios catódicos.
Dois anos após as observações de Hertz, J.J. Thomson provou que as partículas emitidas pelas placas iluminadas tratava-se de elétrons. Para tanto, Thomson provou que a razão carga e massa (e/m) das partículas catódicas era igual à dos elétrons — partículas descobertas por ele mesmo, alguns anos antes.
Veja também: A descoberta do elétron
Em 1903, o assistente de Hertz, Philipp Lenard, desenvolveu uma série de experimentos com o intuito de estabelecer uma relação entre a intensidade da luz e a energia dos elétrons emitidos, Lenard concluiu que não havia qualquer dependência entre as duas coisas, o que era esperado, segundo os conhecimentos de Física daquela época. Um ano depois, Schweilder conseguiu provar que a energia cinética dos elétrons que deixavam as placas metálicas era diretamente proporcional à frequência de luz que as iluminava.
Os resultados obtidos experimentalmente contradiziam a teoria clássica do eletromagnetismo e tornaram-se um grande desafio para os físicos da época por cerca de 18 anos. No ano de 1905, Einstein fez uso de uma proposta apresentada por Planck, explicando, de forma satisfatória, o funcionamento do efeito fotoelétrico. A proposta utilizada por Einstein chama-se quantização do campo eletromagnético. No ano de 1900, Planck tentava, de todas as formas, explicar a emissão de corpo negro, e só conseguiu fazê-lo ao sugerir que a luz fosse quantizada, isto é, que apresentasse valores de energia múltiplos de uma quantidade menor. Apesar de Planck ter entendido que o seu feito era somente um artifício matemático capaz de explicar um fenômeno físico, Einstein acreditou que a luz realmente fosse formada por um grande número de partículas dotadas de energia. Futuramente, tais partículas viriam a ser chamadas de fótons.
Após a publicação de seu artigo sobre o efeito fotoelétrico, Einstein foi laureado com o prêmio Nobel de Física em 1921.
Saiba mais sobre: O que são fótons?
Fórmulas
De acordo com a teoria corpuscular da luz, proposta por Planck e usada por Einstein para a explicação do efeito fotoelétrico, a luz é formada por um grande número de fótons — partículas sem massa que carregam uma pequena quantidade de energia. Essa energia é proporcional à frequência da luz e também à constante de Planck (h = 6,662.10-34 J.s), como mostra a equação seguinte:
![]()
E — energia dos fótons
h — constante de Planck
f — frequência da luz
Caso a energia de um fóton seja grande o suficiente, ela pode arrancar elétrons do material. A energia cinética de um elétron ejetado pode ser calculada por meio da seguinte equação:
.jpg)
K — energia cinética dos elétrons
E — energia do fóton
Φ — função trabalho
De acordo com a expressão acima, a energia cinética adquirida pelos elétrons (K) depende da energia dos fótons incidentes (E) e também de Φ (função trabalho). Tal grandeza mede a quantidade de energia potencial pela qual os elétrons encontram-se ligados ao material, trata-se da energia mínima necessária para arrancá-los. Portanto, toda a energia excedente é transferida para os elétrons em forma de energia cinética. Aqui é importante perceber que a energia cinética adquirida pelos elétrons depende exclusivamente da frequência da luz incidente e não da intensidade da luz que é emitida.
A frequência da luz, e não a sua intensidade, é que determina se os elétrons serão ejetados.
Tabela de função trabalho
Confira a medida de função trabalho de alguns materiais conhecidos. Essa função refere-se à quantidade mínima de energia exigida para os elétrons serem arrancados da superfície do material:
|
Material |
Função trabalho (eV) |
|
Alumínio |
4,08 |
|
Cobre |
4,7 |
|
Ferro |
4,5 |
|
Platina |
6,35 |
|
Prata |
4,73 |
|
Zinco |
4,3 |
Experimento do efeito fotoelétrico
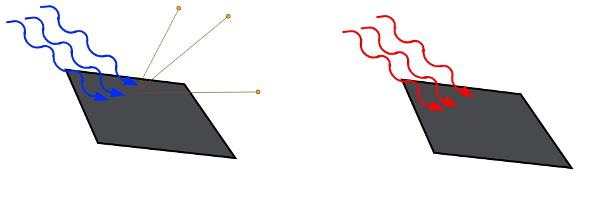
Observe a figura abaixo, nela apresenta-se um esquema simplificado do arranjo experimental, utilizado por Phillip Lenard, para o estudo do efeito fotoelétrico:
Esquema experimental utilizado para o estudo do efeito fotoelétrico.
O experimento consistia em duas placas metálicas, paralelas, ligadas a uma bateria. No circuito havia amperímetros, usados para medir a corrente elétrica entre as duas placas, e voltímetros, usados para medir a tensão elétrica estabelecida pela bateria.
Quando essa bateria era iluminada por certas frequências de luz, alguns elétrons eram emitidos por uma das placas, que adquiria cargas positivas (cátodo). Ao serem acelerados por uma diferença de potencial fornecida pela bateria, os elétrons chegavam à outra placa. Tal corrente elétrica era medida pelo amperímetro.
Lenard percebeu que, aumentando-se a intensidade da luz, mais elétrons eram ejetados a cada segundo. No entanto, mantendo-se constante a frequência da luz emitida pela fonte luminosa, a energia com que os elétrons eram ejetados não mudava. Observe o gráfico a seguir:
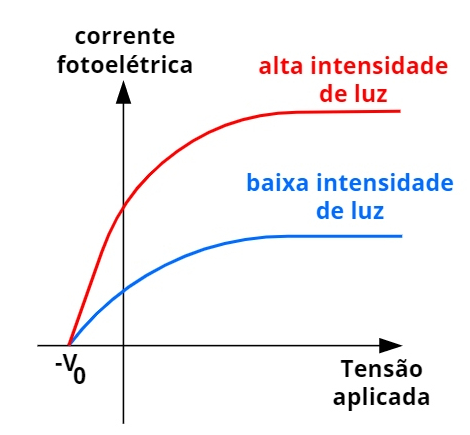
A corrente de saturação corresponde ao número de elétrons ejetados pela placa iluminada a cada segundo.
A figura acima relaciona a corrente elétrica produzida pelos elétrons, ejetados por uma placa e captados pela outra placa, com o potencial elétrico estabelecido entre elas. Ao aplicar-se esse potencial, os elétrons que apenas deixavam a placa, mesmo com energia cinética nula, chegavam à outra placa. Quando todos os elétrons ejetados chegam à outra placa, a corrente elétrica satura-se, isto é, passa a se manter constante. O que se percebe é que a corrente de saturação depende da intensidade luminosa: quanto maior é a intensidade da luz, maior é a corrente elétrica formada entre as placas.
Entretanto, quando se aplica um potencial elétrico contrário, de modo a retardar o movimento dos elétrons que se dirigem de uma placa até a outra, é observado que existe um potencial elétrico mínimo (V0), chamado potencial de corte, por meio do qual nenhum elétron consegue chegar à outra placa. Isso indica que a energia cinética com que os elétrons deixam as placas não depende da intensidade da luz. A energia cinética máxima dos elétrons pode ser calculada por meio da seguinte equação:
![]()
K — energia cinética máxima dos elétrons
e — carga fundamental (1,6.10-19 C)
V0 — potencial de corte
Elétron-Volt
Uma vez que os módulos de energia cinética dos elétrons têm módulos muito baixos para serem medidos em Joules, essas medidas de energia são corriqueiramente feitas em uma outra unidade muito menor, o elétron-Volt (eV). O elétron-Volt é a quantidade de energia potencial elétrica experimentada por uma partícula carregada com o menor valor de carga existente, a carga fundamental, quando colocada em uma região de potencial elétrico igual a 1 V. Logo, 1 eV é equivalente a 1,6.10-19 J.
![]()
Além do elétron-Volt, é comum o uso de prefixos como: keV (quiloelétrons-Volts, 103 eV), MeV (megaelétron-Volts,106 eV), TeV (teraelétron-Volts, 109 eV) etc.
Aplicações tecnológicas do efeito fotoelétrico
Diversas aplicações tecnológicas surgiram com base na explicação do efeito fotoelétrico. A mais famosa delas seja talvez a das células fotovoltaicas. Essas células são as unidades básicas dos painéis solares, por meio delas é possível converter a energia luminosa em corrente elétrica. Confira uma lista com as principais invenções baseadas no efeito fotoelétrico:
-
Células fotovoltaicas;
-
Relés;
-
Sensores de movimento;
-
Fotorresistores.
Exercícios resolvidos
1) Certa substância, quando iluminada por fótons de 4 eV, é capaz de ejetar elétrons com energia de 6 eV. Determine a módulo da função trabalho de tal substância.
Resolução:
Utilizaremos a equação da função trabalho para calcularmos essa grandeza, observe:
![]()
Sendo a energia cinética dos elétrons ejetados (K) igual a 6 eV e a energia dos fótons incidentes (E) igual a 4 eV, teremos:
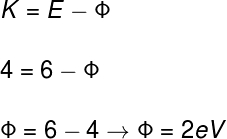
De acordo com o cálculo feito, a função trabalho desse material, ou seja, a energia mínima para ejetar os elétrons, é de 2 eV.
2) Ao iluminarmos uma placa metálica cuja função trabalho é de 7 eV, observa-se a ejeção de elétrons com energias de 4 eV. Determine:
a) a energia dos fótons incidentes;
b) a frequência dos fótons incidentes.
Resolução:
a) Vamos determinar a energia dos fótons da luz incidente por meio da função trabalho:
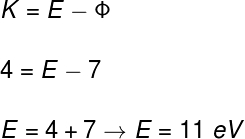
b) Para calcularmos a frequência dos fótons, podemos usar a seguinte equação:
![]()
Tomando os dados fornecidos pelo exercício, teremos o seguinte cálculo:
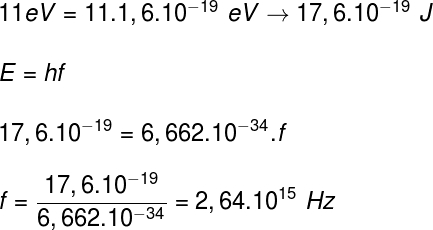
Por Rafael Helerbrock