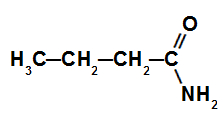A hidrólise de amidas é uma reação orgânica alternativa utilizada para a obtenção de importantes substâncias orgânicas, como ácidos carboxílicos e sais de ácidos carboxílicos, e inorgânicas, como sais e amônia.
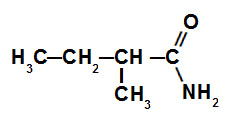
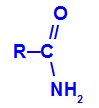
As amidas são compostos orgânicos que apresentam na sua composição o grupo carbonila (C=O) ligado a um grupo amino (NH2), como na representação proposta a seguir:
Em uma reação de hidrólise de amidas, temos a influência da molécula de água sobre a molécula da amida, formando o grupo oxiamônio (O-NH4), que é um oxigênio ligado ao cátion amônio. O oxiamônio resulta da interação entre a molécula de água e o grupo amino:
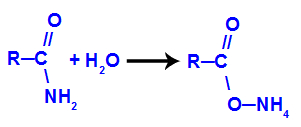
Equação que representa a formação do grupo oxiamônio
Vale ressaltar que a obtenção dos produtos finais depende sempre do meio no qual a amida está inserida, se ácido ou básico, como veremos a seguir:
Hidrólise de amidas em meio ácido
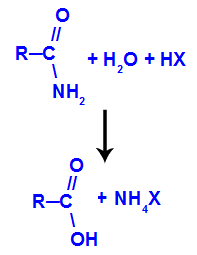
Quando uma amida é colocada em uma solução com um ácido inorgânico e água, ocorre a chamada hidrólise de amida em meio ácido (solução que apresenta um pH menor que 7 e grande quantidade de hidrônios).
Como já sabemos, inicialmente, forma-se o grupo oxiamônio resultante da associação da molécula de água com o grupo amino da amida. Na solução, temos ainda a presença do cátion hidrônio (H+) e de um ânion qualquer (X-) provenientes do ácido.
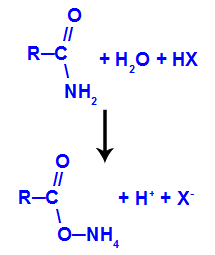
Representação da formação do oxiamônio em meio ácido
Como na solução existem hidrônios em grande quantidade e sendo eles mais eletropositivos que o cátion amônio (NH4+), o hidrônio desloca o amônio, formando um ácido carboxílico, como na equação a seguir:
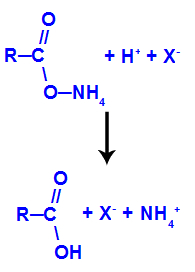
Formação do ácido carboxílico pela troca do amônio pelo hidrônio
O cátion amônio livre na solução após ter sido deslocado pelo hidrônio une-se aos ânions (X-) provenientes do ácido, formando um sal inorgânico.

Formação do sal inorgânico pela união do amônio e do ânion
Veja a equação que representa os produtos obtidos a partir da reação de hidrólise de uma amida em meio ácido:
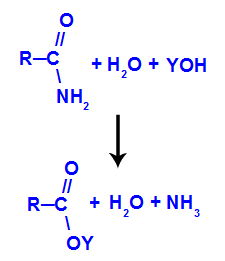
Hidrólise de amidas em meio básico
Quando uma amida é colocada em uma solução com uma base inorgânica e água, ocorre a chamada hidrólise de amida em meio básico (solução que apresenta um pH maior que 7 e grande quantidade de hidróxidos).
Como já sabemos, inicialmente, forma-se o grupo oxiamônio resultante da associação da molécula de água com o grupo amino da amida. Na solução, temos ainda a presença de um cátion qualquer (Y+) e do ânion hidróxido (OH-) provenientes da base.
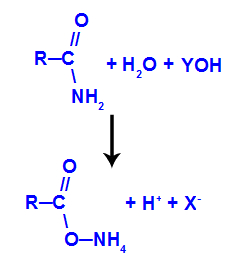
Representação da formação do oxiamônio em meio básico
Como na solução existem cátions quaisquer (Y+) em grande quantidade e sendo eles mais eletropositivos que o cátion amônio (NH4+), o cátion Y desloca o amônio, formando um sal de ácido carboxílico, como na equação a seguir:
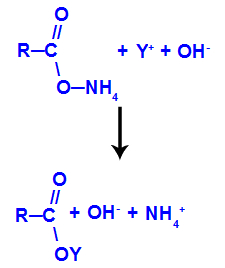
Formação do sal de ácido carboxílico pela troca do amônio pelo cátion Y
O cátion amônio livre na solução após ter sido deslocado pelo cátion Y une-se aos ânions hidróxido (OH-) provenientes da base e forma o hidróxido de amônio (NH4OH). Todavia, o hidróxido de amônio é uma substância bastante instável e, por isso, decompõe-se em amônia e água:
.jpg)
Formação da amônia e água a partir da decomposição do hidróxido de amônio
Veja a equação que representa os produtos obtidos a partir da reação de hidrólise de uma amida em meio básico:
Por Me. Diogo Lopes Dias