O fosfato é um íon que, ao se ligar a outras espécies químicas (átomo, íon ou molécula), forma compostos que caracterizam o grupo dos fosfatos. Nesse contexto, sua presença é essencial para a vida, uma vez que atua em processos biológicos (como na molécula de ATP, que fornece a força motriz para muitas reações bioquímicas dentro das células), bem como na formação de minerais importantes para a manutenção de fósforo nos organismos vivos.
Leia também: O que é o fósforo branco?
Tópicos deste artigo
- 1 - Resumo sobre fosfato
- 2 - O que é o fosfato?
- 3 - Para que serve o fosfato?
- 4 - Características do fosfato
- 5 - Quais são os tipos de fosfato?
- 6 - Onde são encontrados os fosfatos?
- 7 - Usos do fosfato no cotidiano
- 8 - Fosfato é poluente ou não?
- 9 - Precauções com o fosfato
- 10 - Descoberta do fosfato
- 11 - Exercícios resolvidos sobre fosfato
Resumo sobre fosfato
-
O fosfato é um ânion poliatômico composto por fósforo e oxigênio.
-
É essencial para processos biológicos, como a formação de ossos e dentes.
-
É encontrado em rochas fosfáticas, solo, água e organismos vivos.
-
É utilizado na agricultura como fonte de fósforo em fertilizantes.
-
Está presente em produtos de limpeza, alimentos e medicamentos.
Não pare agora... Tem mais depois da publicidade ;) -
Seu excesso pode contribuir para a eutrofização em corpos d'água.
-
As precauções em relação a ele incluem manuseio seguro, armazenamento adequado e descarte responsável.
O que é o fosfato?
O fosfato é um ânion poliatômico caracterizado por um átomo de fósforo central rodeado por quatro átomos de oxigênio, com a fórmula química PO₄³⁻, em uma disposição tetraédrica, conforme pode ser visto na imagem abaixo:
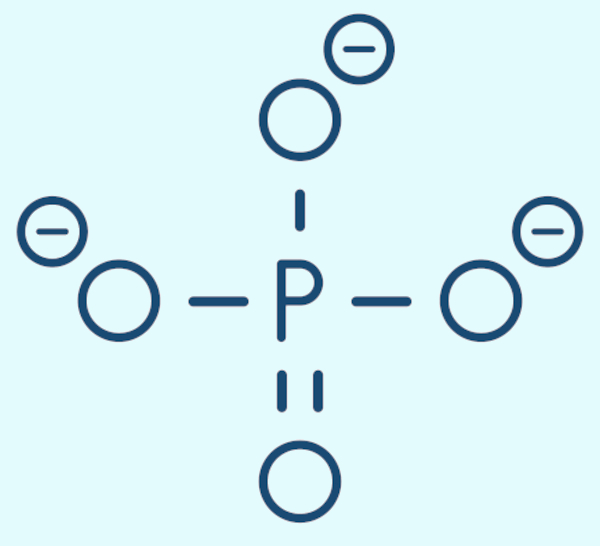
Devido a sua composição química, o fosfato consegue estabelecer ligações iônicas com diferentes tipos de cátions, sejam monoatômicos, sejam poliatômicos, e gerar compostos em diferentes proporções de átomos de fósforo e de oxigênio, como o fosfato trissódico (Na₃PO₄) e o fosfato de cálcio [Ca₃(PO₄)₂].
Veja também: Flúor — elemento químico altamente tóxico presente em 20% dos produtos farmacêuticos
Para que serve o fosfato?
Devido a sua característica iônica de se ligar a diversos tipos de cátions, o fosfato forma compostos com diferentes propriedades físico-químicas, as quais contribuem para suas aplicações nas mais variadas áreas, inclusive em processos biológicos naturais, como armazenar e transportar fósforo em organismos vivos, processo essencial para várias funções biológicas. Diante disso, podemos citar algumas de suas principais aplicações:
-
Na formação de ossos e dentes: em que o fosfato está presente na forma de hidroxiapatita, um mineral que confere resistência e rigidez a esses tecidos.
-
No metabolismo energético: em que o fosfato está presente no ATP (adenosina trifosfato), a principal molécula utilizada pelas células para armazenar e transferir energia. A molécula de ATP tem em sua constituição três fosfatos ligados entre si, os quais são essenciais para a produção de energia nas células.
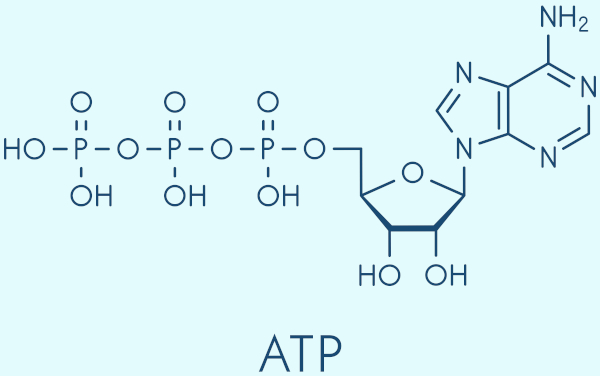
- Na síntese de ácidos nucleicos: o fosfato é um componente fundamental do DNA e do RNA, as moléculas responsáveis pelo armazenamento e transmissão da informação genética. Além disso, ele atua como um tampão biológico, ajudando a manter o pH adequado em fluidos corporais, como o sangue e a urina.
-
Em várias vias de sinalização celular: desempenhando um papel crucial na regulação de processos celulares, como crescimento, diferenciação e sobrevivência celular.
Por fim, não podemos deixar de citar a sua importância para a indústria, principalmente na produção de fertilizantes, detergentes, alimentos e produtos químicos. Perceba que se trata de uma espécie química com uma gama de aplicações, pois participa de vários processos físicos e químicos, principalmente na formação de substâncias.
Características do fosfato
Como o fosfato é um íon que se liga a outras espécies químicas para formar substâncias, é válido conhecer as suas características:
-
Tem uma carga de -3 devido à presença de três elétrons não compartilhados no átomo de fósforo, que formam ligações covalentes com os átomos de oxigênio.
Não pare agora... Tem mais depois da publicidade ;) -
Sua geometria é tetraédrica, com o átomo de fósforo no centro e os átomos de oxigênio nos vértices do tetraedro.
-
É geralmente solúvel em água, especialmente em pH neutro a ligeiramente básico. No entanto, alguns fosfatos podem ter solubilidade limitada em pH ácido.
-
É relativamente estável, mas pode reagir com ácidos fortes, para formar ácido fosfórico, ou com bases fortes, para formar fosfatos insolúveis em água.
-
É polar devido à sua carga negativa, o que o torna solúvel em solventes polares, como a água.
Quais são os tipos de fosfato?
Existem vários tipos de fosfatos, que podem ser classificados de acordo com sua estrutura química, origem e aplicação. Portanto, falaremos aqui dos seus tipos quanto aos seus aspectos gerais, classificando-os da seguinte forma:
-
Fosfatos inorgânicos: são compostos por íons de fosfato e íons metálicos, como: o fosfato trissódico (Na₃PO₄) e o fosfato de cálcio [Ca₃(PO₄)₂], frequentemente usados na indústria como fertilizantes, aditivos alimentares, agentes de limpeza e em processos químicos industriais.
Não pare agora... Tem mais depois da publicidade ;) -
Fosfatos orgânicos: são ésteres do ácido fosfórico encontrados em moléculas biológicas importantes, como o ATP, e em compostos como o DNA e o RNA.
-
Fosfato de rocha: é um mineral natural que contém fosfato na forma de apatita, conforme pode ser visto abaixo:

Onde são encontrados os fosfatos?
Quanto às origens dos fosfatos, podemos encontrá-los na natureza em diversos locais, que vão desde o solo aos organismos vivos. Nesse contexto, organizamos no quadro abaixo as principais fontes desse grupo:
|
Fontes de fosfato |
Descrição |
|
Rochas fosfáticas |
Principais fontes de fosfatos utilizados na produção de fertilizantes. Contêm minerais fosfatados, como a apatita, uma fonte importante de fósforo. |
|
Solo |
Pode conter fosfatos naturais provenientes da decomposição de rochas fosfatadas, essenciais para o crescimento das plantas. |
|
Água |
O fosfato existe em corpos d'água, devido à erosão de rochas fosfatadas e à atividade humana, como o uso de fertilizantes e produtos químicos. |
|
Organismos vivos |
O fosfato é encontrado em plantas, animais e microrganismos, essenciais para a vida. |
|
Depósitos submarinos |
Formados pela acumulação de sedimentos ricos em fosfatos ao longo de milhões de anos. Podem ser uma fonte potencial de fosfatos para uso humano. |
Usos do fosfato no cotidiano
Até aqui você já deve ter percebido que os fosfatos têm uma série de aplicações, logo, seu uso no cotidiano é bem variado e amplo. Assim, podemos destacar alguns usos habituais dessa espécie em seus compostos, por exemplo:
São usados como fonte de fósforo em fertilizantes para promover o crescimento saudável das plantas, uma vez que o fósforo é um nutriente essencial para o desenvolvimento de raízes, flores e frutos. Também são utilizados como aditivos alimentares em uma variedade de produtos alimentícios, como refrigerantes, queijos, carnes processadas e produtos de panificação. Além disso, podem ser usados como emulsificantes, estabilizadores, acidulantes e agentes de textura.
Nesse sentido, são frequentemente encontrados em detergentes e produtos de limpeza, devido às suas propriedades de remoção de sujeira e gordura. Alguns produtos, como cremes dentais e enxaguantes bucais, podem conter fosfatos de cálcio para fortalecer os dentes, bem como em suplementos minerais de fósforo, especialmente em casos de deficiência dele.

Por fim, podemos citar que, em algumas áreas, fosfatos são adicionados à água potável como agentes sequestrantes para evitar a corrosão de tubulações de metal e para controlar o depósito de minerais.
Fosfato é poluente ou não?
O fosfato pode ser considerado um poluente em certas situações, especialmente quando em excesso em ambientes aquáticos. Nesse sentido, o principal problema relacionado a ele como poluente está ligado à eutrofização, fenômeno causado pelo enriquecimento excessivo de nutrientes, como fosfatos e nitratos, em corpos d’água.
Sendo assim, quando há um aumento significativo de fosfato na água, geralmente devido ao escoamento de fertilizantes agrícolas, efluentes industriais ou domésticos, ocorre um crescimento excessivo de algas. Portanto, esse descontrole pode levar à formação de florescências de algas — densas concentrações de algas na superfície aquática —, conforme pode ser visto a seguir:

Dessa forma, essas florescências podem ter efeitos negativos no ecossistema aquático, como:
-
Redução do oxigênio dissolvido: o que pode levar à morte de peixes e outros organismos aquáticos.
-
Alterações na cadeia alimentar: pode alterar a disponibilidade de alimentos para outros organismos aquáticos.
Não pare agora... Tem mais depois da publicidade ;) -
Impactos na saúde humana: algumas florescências de algas podem liberar toxinas que são prejudiciais à saúde humana, principalmente se a água contaminada for utilizada para consumo humano ou recreação.
Assim, embora o fosfato seja um nutriente essencial para a vida, é importante controlar sua liberação no meio ambiente para evitar problemas de poluição e eutrofização em corpos d’água.
Saiba mais: Nitratos — o que são, para que servem, como são usados no dia a dia
Precauções com o fosfato
No que tange às precauções em relação ao fosfato, devemos considerar especialmente a sua manipulação e uso quando incorporado em seus compostos usuais, conforme pontuados abaixo:
|
Precaução |
O que fazer? |
|
Manuseio seguro |
Na forma concentrada ou em pó, é importante usar equipamento de proteção pessoal, como luvas e óculos de proteção, para evitar irritação na pele e nos olhos. |
|
Armazenamento adequado |
Deve ser armazenado em local seguro, longe de fontes de calor, chamas abertas e materiais incompatíveis. Portanto, deve-se seguir as instruções do fabricante para o armazenamento correto do produto. |
|
Evitar ingestão |
Não deve ser ingerido, pois pode causar irritação no trato gastrointestinal. Em caso de ingestão acidental, deve-se procurar ajuda médica imediatamente. |
|
Descarte adequado |
Não deve ser descartado em esgotos, rios ou lagos, pois pode contribuir para a poluição da água e causar problemas ambientais. |
|
Uso responsável |
Ao utilizar produtos contendo fosfato, como detergentes ou fertilizantes, deve-se seguir as instruções do rótulo e evitar o uso excessivo, que pode contribuir para a poluição ambiental. |
|
Monitoramento ambiental |
É importante monitorar os níveis de fosfato em ambientes aquáticos para evitar a eutrofização e seus impactos negativos no ecossistema. |
Descoberta do fosfato
A descoberta do fosfato está associada à descoberta do fósforo, ocorrida no século XVII, quando o alquimista alemão Hennig Brandt aqueceu urina, resultando na obtenção de fósforo branco. Posteriormente, químicos como Carl Wilhelm Scheele e Johann Heinrich Pott identificaram que o fósforo poderia ser obtido de minerais fosfatados, como a apatita. Essa descoberta foi crucial para entender a ligação entre o fósforo e os fosfatos.
Já no século XIX, os fosfatos, especialmente o fosfato de cálcio, foram reconhecidos como componentes essenciais de ossos e dentes, impulsionando sua importância na saúde e nutrição. Com o tempo, os fosfatos tornaram-se fundamentais para a agricultura, devido à sua capacidade de fornecer fósforo para o crescimento das plantas, levando ao desenvolvimento de técnicas de extração de fosfatos de rochas fosfatadas e à produção em larga escala de fertilizantes fosfatados.
Exercícios resolvidos sobre fosfato
Questão 1. Considerando a importância dos fosfatos na agricultura, qual é a principal fonte desses compostos utilizada na produção de fertilizantes?
-
Rochas fosfáticas, ricas em minerais fosfatados.
-
Água potável, que contém fosfatos dissolvidos naturalmente.
-
Solo fértil, que libera fosfatos durante o processo de decomposição.
-
Organismos vivos, que produzem fosfatos como subproduto metabólico.
e) Poluição urbana, que produz chuva ácida e precipita os íons fosfato no solo.
Gabarito: letra a
As rochas fosfáticas são a principal fonte de fosfatos utilizados na produção de fertilizantes, pois contêm minerais fosfatados, como a apatita, que são ricos em fósforo.
Questão 2. O aumento dos níveis de fosfato em corpos d'água pode desencadear um processo conhecido como eutrofização. Por que isso ocorre e quais são os impactos desse fenômeno?
-
Esse fenômeno é oriundo do aumento da salinidade da água, prejudicando a vida aquática.
-
Ocorre devido ao crescimento excessivo de algas, que consomem o oxigênio da água.
-
A causa está na acidificação da água, causando a morte de peixes e outros organismos.
Não pare agora... Tem mais depois da publicidade ;) -
Ocorre devido à redução da turbidez da água, facilitando a penetração da luz solar.
-
O principal motivo está no aumento da fauna aquática, gerando uma redução de nutrientes para as espécies competitivas.
Gabarito: letra b
O aumento dos níveis de fosfato estimula o crescimento excessivo de algas, levando à eutrofização. Quando essas algas morrem, são decompostas por bactérias, que consomem o oxigênio da água, causando a morte de organismos aquáticos devido à falta de oxigênio.
Fontes
ALMANASSRA, I. W. et al. Review of phosphate removal from water by carbonaceous sorbents. Journal of Environmental Management, 2021.
CHRISTENSEN, M. L. et al. Precipitation and recovery of phosphorus from the wastewater hydrolysis tank. Science of the Total Environment, v. 813, 2022.
CORRALES RAMÍREZ, MSC, L. C.; ARÉVALO GALVEZ, Z. Y.; MORENO BURBANO, V. E. Solubilización de fosfatos: una función microbiana importante en el desarrollo vegetal. Nova, v. 12, n. 21, 2014.
EL BAMIKI, R. et al. Phosphate rocks: A review of sedimentary and igneous occurrences in Morocco. Minerals, 2021.
KAMINSKI, J.; PERUZZO, G. Eficácia de fosfatos naturais reativos em sistemas de cultivo. Boletim Técnico N°3, Núcleo Regional Sul da Sociedade Brasileira de Ciência do Solo., v. 10, n. 3, 1997.
LOPES, A. R. C. Reações químicas: fenômenos, transformação e representação. Química Nova na Escola, v. 2, p. 7–9, 1995.
MÜLLER, W. E. G.; SCHRÖDER, H. C.; WANG, X. Inorganic Polyphosphates As Storage for and Generator of Metabolic Energy in the Extracellular Matrix. Chemical Reviews, 2019.
SHIMADA, M.; SHUTTO-UCHITA, Y.; YAMABE, H. Lack of awareness of dietary sources of phosphorus is a clinical concern. In Vivo, 2019.
STINCONE, A. et al. The return of metabolism: Biochemistry and physiology of the pentose phosphate pathway. Biological Reviews, v. 90, n. 3, p. 927–963, 2015.
TARAYRE, C. et al. Characterisation of phosphate accumulatingorganisms and techniques for polyphosphatedetection: A review. Sensors (Switzerland), 2016.
VERVLOET, M. G. et al. The role of phosphate in kidney disease. Nature Reviews Nephrology, 2017.

