Solução-tampão é uma mistura homogênea que não sofre variação de pH ou de pOH quando a essa mistura são adicionadas pequenas quantidades de ácido forte ou de base forte. Porém, a mistura não sofre alteração de pH ou pOH apenas se apresentar uma das duas composições abaixo:
-
Tampão ácido (pH menor que 7):
Possui ácido fraco misturado com um sal solúvel que apresenta o mesmo ânion, como o ácido cianídrico (HCN) e o cianeto de potássio (KCN), os quais apresentam o mesmo ânion cianeto (CN).
-
Tampão básico (pH maior que 7):
Base fraca misturada com um sal que apresenta o mesmo cátion, como o hidróxido de zinco [Zn(OH)2] e o cloreto de zinco (ZnCl2), os quais apresentam o mesmo cátion zinco (Zn+2).
É importante, para compreender a influência que uma solução-tampão sofre ao receber um ácido ou base forte, relembrar quando ácidos e bases são considerados fortes:
→ Classificação das bases quanto à força
-
Fortes: bases que apresentem elementos químicos das famílias IA (metais alcalinos) e IIA (metais alcalinoterrosos), com exceção do magnésio;
-
Fracas: bases que apresentem o elemento magnésio e outro, desde que não pertença às famílias IA e IIA.
→ Classificação dos ácidos quanto à força
a) Para os hidrácidos (ácidos sem oxigênio):
-
Fortes: apenas o HCl, HBr e HI;
-
Moderados: apenas o HF;
Não pare agora... Tem mais depois da publicidade ;) -
Fracos: qualquer outro hidrácido.
b) Para os oxiácidos (ácidos com oxigênio):
-
Fortes: quando a subtração do número de oxigênios pelo número de hidrogênios é igual ou superior a 2;
-
Moderados: quando a subtração do número de oxigênios pelo número de hidrogênios é igual a 1;
-
Fracos: quando a subtração do número de oxigênios pelo número de hidrogênios é igual ou menor que 0.
Influência da adição de uma base forte a um tampão
Para explicar, vamos utilizar a solução-tampão formada pelo hidróxido de zinco [Zn(OH)2] e o sal solúvel cloreto de zinco (ZnCl2), o qual receberá uma pequena quantidade da base forte hidróxido de sódio (NaOH). Veja os equilíbrios presentes nessa solução-tampão:
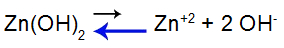
Equação do equilíbrio de dissociação da base
O equilíbrio desloca-se à esquerda porque a base é fraca.
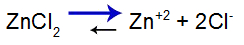
Equação do equilíbrio de dissociação do sal
O equilíbrio desloca-se à direita porque o sal é solúvel.
A base forte apresenta o seguinte equilíbrio:
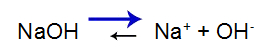
Equação do equilíbrio de dissociação da base
O equilíbrio desloca-se à direita porque a base é forte.
A base forte adicionada libera em água o ânion hidróxido (OH-), que possui grande afinidade pelos cátions zinco (Zn+2) provenientes do sal no segundo equilíbrio. A associação entre hidróxido e zinco forma o hidróxido de zinco:
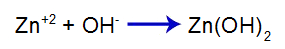
Equação de formação da base
Assim, o OH- da base diminui a quantidade de zinco no segundo equilíbrio e aumenta a quantidade da base [Zn(OH)2], fazendo com que ela se dissocie mais e libere cátions Zn+2 no primeiro equilíbrio. Como não vamos ter alteração na quantidade de hidróxido no meio, logo, o pH não se altera.
Influência da adição de um ácido forte a um tampão
Para explicar, vamos utilizar o tampão formado pelo hidróxido de zinco [Zn(OH)2] e pelo sal solúvel cloreto de zinco (ZnCl2), o qual receberá uma pequena quantidade do ácido iodídrico (HI), que é forte. Veja os equilíbrios presentes no tampão:
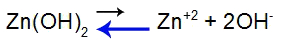
Equação de equilíbrio de dissociação da base
Equilíbrio deslocado à esquerda pelo fato de a base ser fraca.
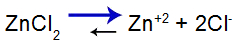
Equação do equilíbrio do sal
Equilíbrio deslocado à direita pelo fato de o sal ser solúvel.
O ácido forte apresenta o seguinte equilíbrio:
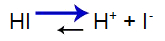
Equação do equilíbrio do ácido
Equilíbrio deslocado à direita pelo fato de o ácido ser forte.
O ácido adicionado produz em água o cátion hidrônio (H+), que possui grande afinidade pelos íons hidróxido (OH-) provenientes da base. A associação entre hidrônio e hidróxido forma uma molécula de água:
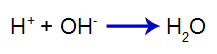
Equação de formação da água
Assim, o H+ do ácido diminui a quantidade de hidróxidos no primeiro equilíbrio, aumentando a dissociação da base. Como não vamos ter alteração na quantidade de hidróxido no meio, logo, o pH não se altera.
Por Me. Diogo Lopes Dias