Kps é a sigla utilizada para representar a constante do produto de solubilidade, que se refere ao produto (multiplicação) das concentrações em quantidade de matéria dos íons presentes em uma solução.
Sempre que um soluto pouco solúvel é adicionado a um solvente, como o sulfato de bário, uma pequena parte desse sal dissolve-se na água, e o restante acumula-se no fundo do recipiente, formando o corpo de fundo. O sal que se dissolve sofre dissociação, liberando cátions e ânions na água.
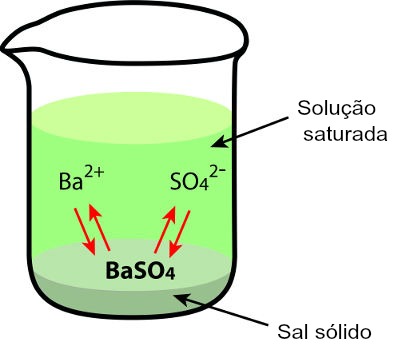
Precipitado presente em uma solução com água e sulfato de bário
Além de o sal não apresentar boa solubilidade, a quantidade de soluto dissolvido não se altera com o passar do tempo porque existe um equilíbrio de dissolução entre os íons do sal (presentes na solução) e o corpo de fundo.

Equilíbrio de dissolução do BaSO4 em água
Kps de um soluto
O Kps de um soluto é o produto das concentrações molares dos íons participantes. É necessário sempre elevar a concentração do íon ao seu respectivo coeficiente estequiométrico (utilizado para balancear a equação).
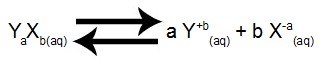
Equilíbrio de dissolução do eletrólito YaXb
O Kps do equilíbrio proposto para o sal YaXb terá a concentração do reagente Y (elevada ao seu coeficiente estequiométrico (a) e a concentração do produto X (elevada ao seu coeficiente estequiométrico (b)).
Kps = [Y+b]a.[X-a]b
Exemplo
Vamos supor que estejamos preparando uma solução com água e cianeto de alumínio [Al(CN)3], que é um sal praticamente insolúvel em água. Quando esse sal é adicionado à água, acaba sofrendo o fenômeno da dissociação.

Equilíbrio de dissolução do eletrólito Al(CN)3
Assim, por meio da equação do equilíbrio de dissolução do sal, temos que o seu Kps terá a multiplicação da concentração do cátion alumínio (Al+3) elevada ao expoente 1 pela concentração do ânion cianeto (CN-1) elevada ao expoente 3.
Kps = [Al+3]1.[CN-1]3
Significados do Kps de um soluto
Ao encontrarmos o Kps de um determinado sal misturado à água, também temos conhecimento da concentração de cada um dos íons da solução. Com esses dados, podemos determinar a classificação de uma solução ou o comportamento do soluto na solução. Considere o equilíbrio a seguir:
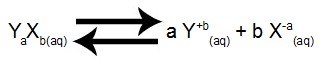
Equilíbrio de dissolução do eletrólito YaXb
Podemos fazer as seguintes relações:
-
Se Kps = [Y+b]a.[X-a]b = 0, temos uma solução saturada sem a presença de precipitado;
-
Se Kps > [Y+b]a.[X-a]b = 0, temos uma solução insaturada, ou seja, uma baixa quantidade de soluto dissolvido no solvente (com relação ao coeficiente de solubilidade);
-
Se Kps < [Y+b]a.[X-a]b = 0, temos uma solução saturada com corpo de fundo, ou seja, haverá uma precipitação do eletrólito (soluto);
-
Se o valor do Kps do eletrólito for muito baixo, trata-se de um material pouco solúvel no solvente.
Exemplo do cálculo do Kps de um soluto
(UERN): A solubilidade do nitrato de cálcio [Ca(NO3)2] em água é 2,0 . 10–3 mol/litro em uma determinada temperatura. O Kps desse sal à mesma temperatura é:
a) 8.10–8.
b) 8.10–10.
c) 3,2.10–10
d) 3,2.10–8
Dados do exercício:
-
Fórmula do sal: Ca(NO3)2;
Não pare agora... Tem mais depois da publicidade ;) -
Concentração molar do sal (solubilidade): 2,0 . 10–3 mol/L.
Para resolver e calcular o Kps, é necessário fazer o seguinte:
Passo 1: Montar o equilíbrio de dissolução do sal.
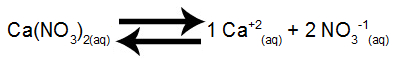
Equilíbrio de dissolução do nitrato de cálcio em água
O nitrato de cálcio, ao sofrer dissociação em água, libera 1 mol de cátions cálcio (Ca+2) e 2 mol de ânions nitrato (NO3-1).
Passo 2: Montar a expressão do Kps do sal
O Kps desse sal terá o produto da concentração do cátion cálcio elevada ao expoente 1 pela concentração do ânion nitrato elevada ao expoente 2, como representado a seguir:
Kps = [Ca+2]1.[NO3-1]2
Passo 3: Determinar os valores das concentrações dos íons na solução
Para calcular o Kps, necessitamos dos valores das concentrações do íons, porém, o exercício forneceu a molaridade do sal na solução. Para determinar a concentração de cada íon, basta multiplicar a molaridade do sal pelo coeficiente estequiométrico do participante na reação:
-
Para o cátion cálcio:
[Ca+2] = 1. 2,0 . 10–3
[Ca+2] = 2,0 . 10–3 mol/L
-
Para o ânion nitrato:
[NO3-1] = 2. 2,0 . 10–3
[NO3-1] = 4,0 . 10–3 mol/L
Passo 4: Utilizar os valores das concentrações encontrados no passo 3 na expressão do Kps (determinada no passo 2).
Kps = [Ca+2]1.[NO3-1]2
Kps = [2.10-3]1.[4.10-3]2
Kps = 2.10-3.16.10-6
Kps = 32.10-9
ou
Kps = 3,2.10-9 (mo/L)
Por Me. Diogo Lopes Dias

