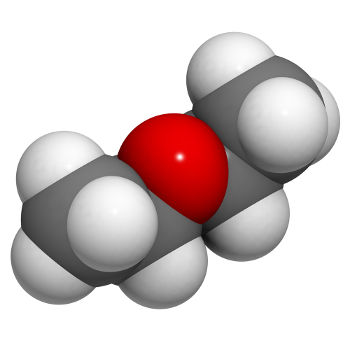
Éter é uma função orgânica oxigenada, isto é, apresenta o elemento químico oxigênio, além de carbono e hidrogênio. Essa função possui como principal característica estrutural a presença de dois radicais orgânicos ligados a um átomo de oxigênio.
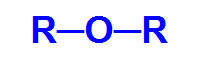
Fórmula estrutural geral de um éter
Assim, a cadeia carbônica de um éter é heterogênea e pode apresentar dois radicais iguais ou diferentes, sejam eles alquila, tipos de radicais que não apresentam estrutura aromática, ou arila, radicais que apresentam estrutura aromática.
Tópicos deste artigo
Características do éter
-
Quanto ao estado físico à temperatura ambiente: quando o éter apresenta de quatro a mais átomos de carbono em sua composição, apresenta-se no estado líquido;
-
Quanto ao ponto de fusão e ao ponto de ebulição: quando comparados com outros compostos orgânicos de massa molar aproximada, possuem ponto de fusão semelhante ao dos alcanos e menor que o restante dos compostos orgânicos;
-
Quanto à densidade: são compostos que apresentam uma densidade pequena quando comparados à água;
-
Quanto às forças de interação: os éteres são compostos com baixa polaridade, interagindo entre si por uma fraca interação dipolo permanente. Com a água e com os alcoóis, os éteres possuem a capacidade de interagir por meio de ligações de hidrogênio.
-
Quanto à polaridade: são compostos que apresentam geometria angular, assim, são polares.
-
Quanto à característica organoléptica: são substâncias que exalam um odor muito agradável, porém sua inalação pode provocar dependência.
Nomenclatura do éter
Prefixo do radical menor + óxi + prefixo do radical maior + infixo + o
Para realizar a nomenclatura oficial de um éter, é fundamental determinar qual é o seu ligante maior e qual é o seu ligante menor. Para tal, acompanhe a seguir dois exemplos de aplicação para essa regra de nomenclatura:
1º Exemplo:
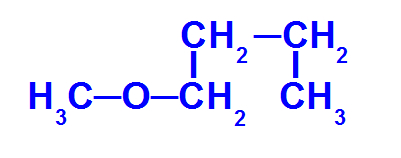
Fórmula estrutural de um éter com menos carbonos
O éter acima apresenta os seguintes radicais:
-
Metil (CH3-);
-
Butil (CH3-CH2-CH2-CH2-).
Para nomear esse composto, temos:
prefixo do radical menor: Met
+
oxi
+
prefixo do radical maior: but
+
an (pois ele apresenta apena ligações simples)
+
o
Então, o nome desse éter será metóxibutano.
2º Exemplo:
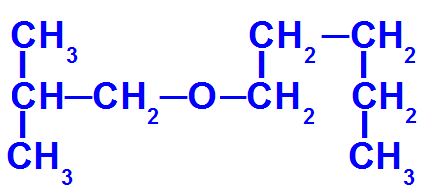
Fórmula estrutural de um éter com mais carbonos
Esse éter apresenta os seguintes radicais:
-
Isobutil [(CH3)2-CH-CH2-);
-
Pentil (CH3-CH2-CH2-CH2-CH2).
Para nomeá-lo, portanto, temos:
prefixo do radical menor: isobut
+
oxi
+
prefixo do radical maior: pent
+
an (pois ele apresenta apena ligações simples)
+
o
Assim, o nome do éter em questão será isobutóxipentano.
-
Nomenclatura usual do éter
Éter + nome dos radicais (mais simples e, depois, o mais complexo) + ico
ou
Nomes dos radicais + éter
Acompanhe abaixo dois exemplos de aplicação para essa regra de nomenclatura:
1º Exemplo:
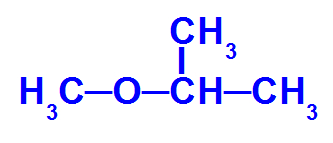
Fórmula estrutural de um éter que apresenta quatro carbonos
Esse éter apresenta os seguintes radicais:
-
Metil (CH3);
-
Isopropil (CH3-CH-CH3).
Portanto, para esse composto, temos:
Éter
+
radical menor: Metil
+
prefixo do radical maior: isopropil
+
ico
Dessa forma, o nome do éter em questão será éter metil-isopropílico, ou, então, metil-isopropil-éter.
2º Exemplo:
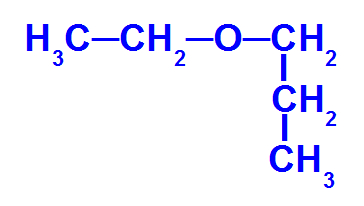
Fórmula estrutural de um éter que apresenta cinco carbonos
O éter acima apresenta os seguintes radicais:
-
Etil (CH3-CH2-);
-
Propil (CH3-CH2-CH2-).
Para nomear esse composto, temos:
Éter
+
radical menor: etil
+
prefixo do radical maior: propil
+
ico
Assim, o nome do éter em questão será éter etil-propílico, que também pode ser etil-propil-éter.
Para que servem os éteres?
De uma maneira geral, os éteres são utilizados:
-
Como solventes orgânicos inertes, isto é, que não participam de nenhuma reação;
-
Utilizados na extração de essências, como de flores, madeira, etc.;
-
Utilizados na extração de diversos óleos e gorduras.