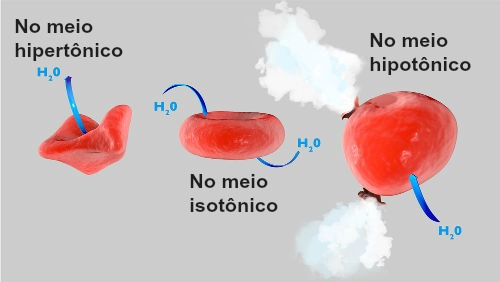
Osmoscopia é uma propriedade coligativa (as outras são tonoscopia, ebulioscopia e crioscopia) que estuda a ocorrência da osmose entre duas soluções de concentrações diferentes, sendo uma delas mais concentrada que a outra.
Obs.: As propriedades coligativas ocorrem quando um soluto não volátil é adicionado a um solvente.
Como a osmoscopia estuda a osmose, é fundamental saber o que é esse fenômeno. Para isso, vamos utilizar as soluções abaixo, que estão separadas por uma membrana semipermeável:
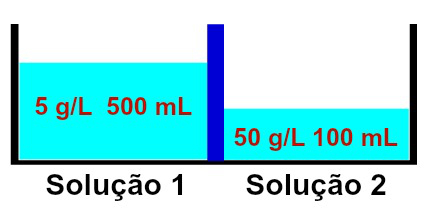
Representação de soluções que possuem concentrações diferentes
Observa-se que a solução 1 contém uma concentração de 5 g/L e um volume de 500 mL, enquanto a solução 2 possui uma concentração de 50 g/L e um volume de 100 mL, separadas por uma membrana semipermeável. A solução 2 é mais concentrada que a solução 1 e, por isso, a osmose deve ocorrer entre elas.
A osmose obrigatoriamente deve acontecer da solução 1 para a solução 2, já que a 1 é menos concentrada. Durante essa ocorrência, parte do solvente atravessa a membrana semipermeável, fazendo com que o volume da solução 2 aumente e o volume da solução 1 diminua, até que ambas as soluções passem a apresentar a mesma concentração, isto é, isotonia.

Modificação na altura das soluções 1 e 2 por causa da ocorrência da osmose
Obs.: Meios isotônicos são aqueles cuja concentração é igual.
De acordo com a osmoscopia, a osmose realiza-se porque a pressão máxima de vapor do solvente na solução menos concentrada é maior do que a do solvente na solução mais concentrada. Agora, se quisermos impedir a ocorrência da osmose, basta exercer uma pressão sobre a solução mais concentrada:
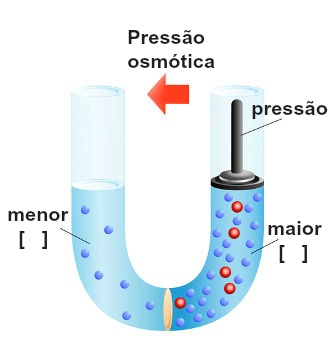
Representação da execução de uma pressão sobre a solução mais concentrada
Essa pressão, que é exercida sobre a solução mais concentrada para bloquear ou até inverter a osmose, é denominada pressão osmótica e é representada pelo símbolo π. Ela deverá ser diretamente proporcional à concentração da solução.
Interpretações possíveis sobre a pressão osmótica
Segundo as conclusões da osmoscopia, cada solução apresenta uma pressão osmótica, uma vez que esta se relaciona com a concentração, característica presente em toda solução.
Na comparação entre meio ou uma solução e outra, podemos utilizar os seguintes termos:
-
Hipertônico: quando um meio apresenta uma pressão osmótica maior que o outro;
-
Hipotônico: quando um meio apresenta uma pressão osmótica menor que o outro;
-
Isotônico: quando os dois meios ou soluções apresentam a mesma pressão osmótica.
Assim, na comparação entre as pressões osmóticas de duas soluções A e B, representadas por πA e πB, podemos afirmar que :
-
Se a pressão osmótica de A e B forem iguais, os meios ou as soluções serão isotônicos:
Não pare agora... Tem mais depois da publicidade ;)
πA = πB
-
Se a pressão osmótica de A for maior que a pressão osmótica de B, o meio A será hipertônico em relação a B:
πA > πB
-
Se a pressão osmótica de B for menor que a pressão osmótica de A, o meio B será hipotônico em relação a B:
πB < πA
Fórmula para calcular a pressão osmótica
π = M.R.T
Nessa fórmula:
-
π = é a pressão osmótica
-
M = é a concentração em mol/L
-
R = é a constante geral dos gases (0,082 para pressão em atm; 62,3 para pressão em mmHg)
-
T = temperatura em Kelvin
Não pare agora... Tem mais depois da publicidade ;)
Como a concentração em mol/L apresenta uma fórmula particular, conforme representação a seguir:
M = m1
M1.V
Podemos substituí-la na fórmula da pressão osmótica:
π = m1.R.T
M1.V
Obs.: Caso o soluto presente na solução seja iônico, devemos utilizar o fator de correção de Van't Hoff (i) na expressão do cálculo da pressão osmótica:
π = M.R.T.i
Exemplo de cálculo da pressão osmótica
Exemplo: (UF-PA) Uma solução contendo 2 mg de um novo antibiótico, em 10 mL de água, a 25 ºC, produz uma pressão osmótica de 0,298 mmHg. Então, a massa molecular desse antibiótico é, aproximadamente:
a) 3000
b) 5200
c) 7500
d) 12500
e) 15300
Os dados fornecidos pelo exercício foram:
-
π = 0,298 mmHg
-
T = 25 oC ou 298 K (após somar com 273)
-
m1 = 2 mg ou 0,002 g (após dividir por 1000)
-
V = 10 mL ou 0,01 L (após dividir por 1000)
Não pare agora... Tem mais depois da publicidade ;) -
R = 62,3 mmHg
Para resolver esse exercício, basta aplicar na expressão para cálculo da pressão osmótica os dados disponibilizados, conforme a seguir:
π = m1.R.T
M1.V
0,298 = 0,002.62,3.298
M1.0,01
0,298.M1.0,01 = 37,1308
0,00298.M1 = 37,1308
M1 = 37,1308
0,00298
M1 = 12460 u
Por Me. Diogo Lopes Dias