Vaporização é o processo físico em que uma amostra no estado líquido muda para o estado gasoso. É um processo endotérmico, ou seja, que envolve a absorção de energia térmica através de trocas de calor. É um processo físico que depende de três fatores externos: pressão ambiente, temperatura do corpo e superfície de contato, sendo influenciado, principalmente, pela natureza do líquido.
Leia também: Você sabe o que é condensação?
Tópicos deste artigo
- 1 - Resumo sobre vaporização
- 2 - Afinal, o que é vaporização?
- 3 - Como acontece a vaporização?
- 4 - Tipos de vaporização
- 5 - Fatores que influenciam a vaporização
- 6 - Vaporização, ebulição e evaporação
- 7 - Exercícios resolvidos sobre vaporização
Resumo sobre vaporização
- Vaporização é a mudança do estado líquido para o estado gasoso.
- A condensação ocorre através de um processo endotérmico, em que uma substância ganha energia térmica.
- A vaporização tem dois tipos distintos: a evaporação e a ebulição.
- Os principais fatores externos que interferem na vaporização são: pressão, temperatura e a superfície de contato.
- A diferença entre evaporação e ebulição está no tempo envolvido no processo. Enquanto a evaporação é lenta e superficial, a ebulição ocorre de forma rápida e em toda a amostra do líquido.
Afinal, o que é vaporização?
![Amostra de água em um processo de vaporização. [imagem_principal]](https://s4.static.brasilescola.uol.com.br/be/2025/09/vaporizacao.jpg)
A vaporização é um processo físico/químico responsável pela mudança do estado físico líquido para o estado físico gasoso. Para que isso ocorra, as moléculas do líquido devem absorver energia térmica através de um processo endotérmico. Dessa forma, as moléculas intensificam seu estado de agitação com o aumento de energia cinética. Como consequência, essas moléculas ocupam mais espaço e tendem a escapar da superfície do líquido para a atmosfera.
Como acontece a vaporização?
A vaporização ocorre quando uma amostra líquida recebe energia térmica através de trocas de calor, ocasionando o aumento da energia cinética das moléculas e, consequentemente, um movimento mais rápido dessas moléculas. Dessa forma, elas tornam-se mais distantes, dentro da estrutura material, separando-se da superfície e mudando de estado. As etapas da vaporização são as seguintes:
- Ganho de energia térmica: Quando o líquido é aquecido, ou exposto em um ambiente com energia suficiente para isso, suas moléculas irão sofrer um processo endotérmico e absorver energia térmica.
- Aumento da agitação das moléculas: A energia absorvida converte-se em energia cinética para as moléculas, aumentando a velocidade e a agitação dessas moléculas.
- Fuga das moléculas: As moléculas na superfície do líquido, com o aumento da velocidade de agitação, podem escapar caso a energia cinética torne-se maior do que a energia de ligação molecular.
É possível acompanhar as condições de vaporização, de pressão e de temperatura, através de um diagrama de fases:
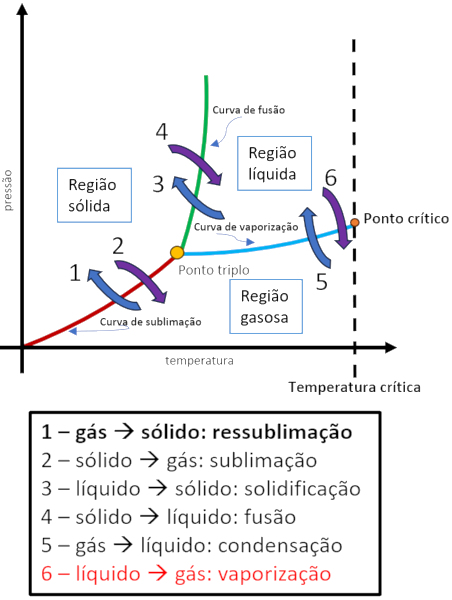
Tipos de vaporização
Existem duas formas principais de vaporização, que se diferenciam pela velocidade e pela forma como o processo ocorre:
- Evaporação: Processo lento e gradual, que ocorre apenas na superfície do líquido. Pode acontecer em qualquer temperatura, mesmo abaixo do ponto de ebulição. Exemplo: roupas secando no varal, formação de nuvens e evaporação de substâncias como acetona.

- Ebulição: Processo intenso e acelerado que ocorre em toda a massa do líquido. Ocorre em uma temperatura específica e constante, para cada substância (conhecido como ponto de ebulição). É caracterizado pela formação de bolhas, por conta do movimento de convecção da massa de líquido. Por exemplo, a fervura da água a 100 °C.

Fatores que influenciam a vaporização
- Temperatura: Quanto maior a temperatura, maior a energia das moléculas e, consequentemente, maior a taxa de vaporização.
- Pressão atmosférica: Afeta diretamente o ponto de ebulição. Em locais de alta altitude, onde a pressão atmosférica é menor, a vaporização ocorre em temperaturas mais baixas.
- Superfícies de contato: Quanto maior a área superficial do líquido, exposta em uma troca de calor, mais acelerada será a vaporização.
- Natureza do líquido: Líquidos com alta volatilidade (forças moleculares mais fracas) possuem mais facilidade para sofrer vaporização, com pontos de ebulição mais baixos.
- Vento/ventilação: O vento ajuda a remover as moléculas de vapor na superfície do líquido, impedindo que muitas condensem, o que acelera a evaporação. Por exemplo, roupas no varal.
Vaporização, ebulição e evaporação
É muito comum haver confusão entre os nomes, mas é preciso destacar as características fundamentais de cada conceito. A vaporização é a transformação de uma amostra do estado líquido para o gasoso, podendo ser descrita como evaporação e como ebulição. A respeito da evaporação e da ebulição, é possível separar os seguintes pontos:
|
|
Evaporação |
Ebulição |
|
Velocidade |
Lenta |
Rápida e intensa |
|
Onde ocorre |
Apenas na superfície |
Em toda a massa do líquido |
|
Temperatura |
Qualquer temperatura |
Apenas no ponto de ebulição |
|
Formação de bolhas |
Não |
Sim |
Acesse também: Fusão — a mudança de estado físico da matéria do sólido para o líquido
Exercícios resolvidos sobre vaporização
Questão 1
Um professor, para ilustrar o aquecimento de uma amostra de água, posiciona um recipiente condutor sobre uma fonte de calor, com um termômetro construído por ele mesmo. Os alunos observam a temperatura da amostra subir de forma gradativa até atingir um valor, mantendo-se constante. Mesmo sem ver o número da escala utilizada, os alunos podem afirmar que
A) a temperatura da água ultrapassou os 100 °C.
B) a temperatura da água não chegou em 100 °C.
C) a temperatura da água chegou aos 100 °C e depois regrediu.
D) a temperatura da água parou em 100 °C.
Resolução:
Alternativa D.
A água, na sua forma líquida, mantém-se nesse estado em um intervalo de 0 °C e 100 °C. Conforme a água é aquecida, ao chegar em 100 °C, a amostra irá começar um processo de mudança de estado, deixando de absorver calor sensível e passando a absorver calor latente.
Questão 2
Para ferver 1 litro de água em uma panela, um aluno gastou cerca de 20 minutos ao usar a boca mais potente do seu fogão. Porém, ao analisar as trocas de calor envolvidas, ele chegou à conclusão de
A) que a água só precisa chegar em 100 °C e depois não requer mais nenhuma troca de calor.
B) que a água após chegar em 100 °C precisa continuar trocando calor para ativar sua mudança de estado.
C) que a água pode ferver antes de chegar em 100 °C por conta da potência da boca do fogão.
D) que a água só precisa de calor latente durante seu aquecimento.
Resolução
Alternativa B.
Para que possa ferver, a água deve atingir a temperatura de 100 °C após o seu aquecimento. Após esse ponto, o calor absorvido pela amostra será na forma de calor latente, sem variação de temperatura.
Fontes
HALLIDAY, David; RESNICK, Robert; WALKER, Jearl (colab.). Fundamentos de física: gravitação, ondas e termodinâmica, volume 2. 10. ed. Rio de Janeiro: LTC - Livros Técnicos e Científicos, 2016.
HEWITT, P. G. Física conceitual. 9. ed. Porto Alegre: Bookman, 2002.
