Fusão é a mudança de estado físico da matéria do sólido para o líquido. Sendo assim, é um fenômeno que ocorre quando uma substância absorve calor suficiente para atingir o seu ponto de fusão e as forças de coesão entre suas partículas. Logo, trata-se de um processo importante em muitos aspectos da vida cotidiana, como cozinhar, derreter materiais para moldagem e até mesmo na produção de objetos de vidro, pois ocorre sempre que um sólido muda para um estado líquido devido ao aumento de temperatura.
Nesse contexto, um exemplo prático de fusão é quando o gelo derrete para formar água líquida quando aquecido. O ponto de fusão da água é de 0 ºC (zero graus Celsius). Portanto, quando você aquece o gelo a uma temperatura superior a 0 ºC, ele se funde, transformando-se em água líquida.
Leia também: Sublimação — passagem direta da fase sólida para a fase gasosa
Tópicos deste artigo
- 1 - Resumo sobre fusão
- 2 - O que é fusão?
- 3 - Como ocorre a fusão?
- 4 - Leis da termodinâmica aplicadas na fusão
- 5 - Calor latente no processo de fusão
- 6 - Exercícios resolvidos sobre fusão
Resumo sobre fusão
- Fusão é um processo físico que ocorre quando uma substância muda de seu estado sólido para o estado líquido devido ao aumento de temperatura.
- Cada substância tem um ponto de fusão específico, que é a temperatura em que ela muda do estado sólido para o líquido.
- A quantidade de energia térmica necessária para permitir a fusão completa de um sólido para um líquido sem aumento de temperatura é chamada de calor latente de fusão.
- A fusão é fundamental em muitos aspectos da vida cotidiana e da indústria, como cozinhar, fabricação de materiais, produção de vidro, entre outros.
- A fusão segue os princípios da termodinâmica, incluindo a primeira lei, que afirma que a energia não pode ser criada nem destruída, apenas transformada.
- O conceito de calor latente é fundamental para entender por que a temperatura não aumenta durante a fusão e como a energia térmica é usada para superar as forças de coesão entre as partículas do sólido.
O que é fusão?
Fusão é um processo físico em que uma substância muda do estado sólido para o líquido devido ao aumento de temperatura. Nesse sentido, quando aquecemos um sólido, como gelo, a uma certa temperatura específica (chamada de ponto de fusão), ele passa a ser líquido.
Esse fenômeno ocorre quando a substância recebe energia térmica suficiente para que suas partículas individuais (átomos, moléculas ou íons) ganhem energia e se movam com mais agitação, perdendo a organização rígida que tinham no estado sólido.

Em outras palavras, o sólido se transforma em líquido quando suas partículas individuais ganham energia, quebram ligações intermoleculares e passam a se mover de forma mais livre e desordenada.
Veja também: Afinal, quais são os 5 estados físicos da matéria?
Como ocorre a fusão?
O processo de fusão pode ser dividido em etapas:
- Aquecimento: o primeiro passo para a fusão ocorrer é o aumento da temperatura da substância sólida, e isso é feito fornecendo calor à substância. Lembre-se de que o calor é uma forma de energia que faz com que as partículas da substância vibrem com mais intensidade. Sendo assim, quanto mais calor é fornecido, mais energia as partículas ganham.
- Ganho de energia: à medida que a substância absorve calor, a energia térmica é transferida para as partículas individuais. Logo, essa energia extra faz com que as partículas fiquem mais agitadas e, consequentemente, mais afastadas umas das outras, pois isso enfraquece as forças de atração entre as partículas e diminui a organização estrutural do sólido.
- Quebra das ligações: no estado sólido, as partículas estão fortemente ligadas umas às outras por forças intermoleculares ou ligações químicas. Diante disso, à medida que as partículas ganham energia térmica, elas começam a vibrar com maior amplitude e quebram essas ligações. Isso permite que as partículas se movam mais livremente.
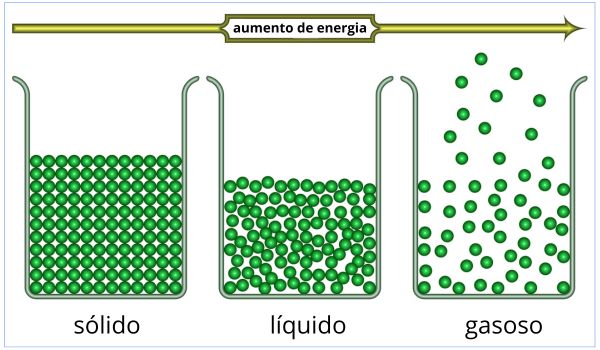
- Transição para o estado líquido: à medida que mais calor é fornecido, mais ligações entre as partículas são quebradas, e a substância sólida gradualmente se transforma em líquido. Nesse ponto, as partículas estão se movendo de forma desordenada, mas ainda estão próximas o suficiente umas das outras para manter a coesão do líquido.
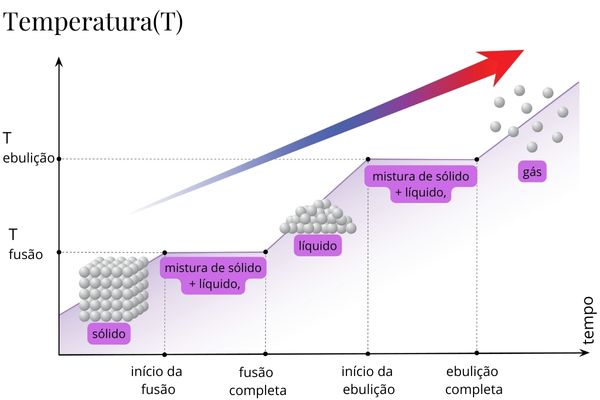
- Temperatura constante: durante o processo de fusão, a temperatura permanece constante até que toda a substância tenha se transformado em líquido. Isso ocorre porque a energia térmica fornecida está sendo usada principalmente para superar as forças de coesão entre as partículas, em vez de elevar a temperatura.
- Estado líquido: após a fusão estar completa, a substância está no estado líquido. As partículas continuam a se mover livremente, deslizando umas sobre as outras, mas agora estão menos organizadas do que no estado sólido.
Leis da termodinâmica aplicadas na fusão
Imagine que você tem um cubo de gelo (estado sólido) a uma temperatura ambiente. Agora, queremos transformar esse gelo em água (estado líquido). Vamos aplicar os conceitos das Leis da Termodinâmica:
- Primeira lei da termodinâmica (conservação de energia): inicialmente, o gelo possui certa quantidade de energia interna, que é determinada pela temperatura. Para fundir o gelo, você precisa fornecer energia térmica a ele na forma de calor. Isso pode ser feito colocando o gelo em um ambiente mais quente, como uma sala à temperatura ambiente. Logo, à medida que você fornece calor ao gelo, ele começa a absorver essa energia, mas a temperatura não aumenta. Isso ocorre porque a energia está sendo usada para romper as forças de ligação entre as moléculas de água sólida, em vez de aumentar a temperatura.
- Segunda lei da termodinâmica (entropia): quando o gelo absorve calor, a entropia do sistema (o gelo) aumenta e as moléculas de água no gelo começam a vibrar mais rapidamente à medida que ganham energia térmica. Sendo assim, a ordem do arranjo cristalino das moléculas de água no gelo é gradualmente perdida, e o sistema se torna mais desordenado quando a transição para o estado líquido ocorre.
- Terceira lei da termodinâmica (zero absoluto): a terceira lei da termodinâmica não é diretamente aplicável aqui, pois estamos operando a temperaturas acima do zero absoluto. No entanto, a terceira lei é fundamental para a compreensão de como os sólidos cristalinos se comportam à medida que a temperatura se aproxima do zero absoluto.
- Lei da conservação de massa: durante todo o processo, a massa das moléculas de água no sistema permanece a mesma. Não ocorre perda ou ganho de massa. A única mudança é a transformação do estado sólido (gelo) para o estado líquido (água).
Resumindo, para transformar o gelo (sólido) em água (líquido), você fornece calor (energia térmica) ao gelo. Esse calor é usado para romper as ligações intermoleculares no gelo, tornando as moléculas mais agitadas e desordenadas. A temperatura do sistema permanece constante durante a fusão porque toda a energia térmica fornecida é usada para a transição de fase, não para aumentar a temperatura. Quando todo o gelo se transforma em água, a entropia do sistema aumentou, e você tem água líquida à temperatura ambiente.
Saiba mais: Ponto de fusão e ponto de ebulição — propriedades que variam nos elementos químicos
Calor latente no processo de fusão
O calor latente é a quantidade de energia térmica que uma substância precisa absorver ou liberar para mudar de fase (como sólido para líquido, líquido para gasoso) sem alterar sua temperatura. Nesse contexto, trata-se da quantidade de calor necessária para fazer um sólido atingir seu ponto de fusão e transformar-se em líquido a uma temperatura constante, por isso também pode ser chamado de calor latente de fusão.
Diante disso, para uma melhor compreensão desse conceito, devemos imaginar as fases envolvidas no processo de fusão como foram explicadas no tópico “Como ocorre a fusão?”. Além disso, com a ajuda de fórmulas matemáticas podemos visualizar melhor como isso ocorre na prática.
Sendo assim, para calcular o calor latente (L) de uma substância, usamos a fórmula:
Q = mL
em que:
Q é a quantidade de calor (energia térmica) envolvida na fusão.
m é a massa da substância que está mudando de fase (Kg).
L é o calor latente de fusão da substância (em joules por quilograma, J/kg).
Essa fórmula calcula a quantidade total de energia térmica necessária para fundir determinada massa de substância e consequentemente, quando rearranjada, o calor latente:
\(L=\frac{Q}{m}\)
Sendo assim, imagine que você tenha uma quantidade específica de gelo com uma massa de 200 gramas (0,2 kg) e você forneceu a ele uma quantidade de calor de 50.000 joules (50 kJ) para derretê-lo. Você deseja calcular o calor latente de fusão (L) da água.
Substituindo os valores:
\(L=\frac{50.000J}{0,2Kg}=250.000c{J}/{Kg}\)
Isso significa que são necessários 250.000 joules de energia para derreter 1 quilograma de gelo a uma temperatura constante, sem que esta mude durante a fusão.
→ Outras aplicações do calor latente de fusão
A essa altura você já deve ter percebido que existem diversas aplicações práticas para esse conceito, como é o caso do aquecimento e resfriamento de uma substância, pois o calor latente é fundamental na determinação de quanta energia é necessária para aquecer ou resfriar uma substância durante uma mudança de fase.
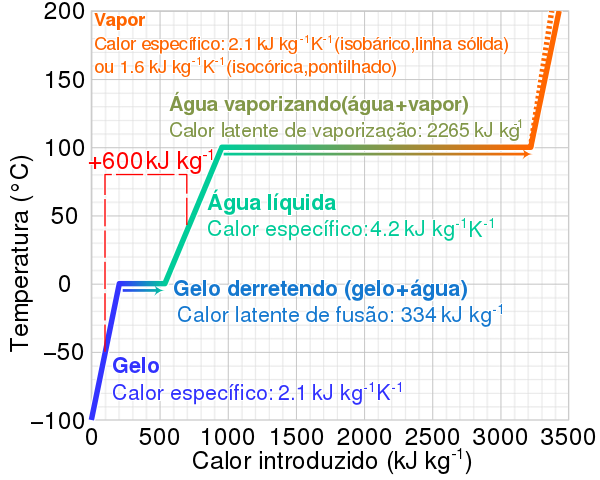
Outros exemplos práticos são:
- Processos industriais: em várias indústrias, como a produção de alimentos, química e metalúrgica, o calor latente é importante para entender e controlar processos de fusão, solidificação e vaporização.
- Aquecimento e ar-condicionado residencial: a compreensão do calor latente é importante no projeto de sistemas de aquecimento e ar-condicionado para garantir que a quantidade certa de calor seja transferida para manter uma temperatura desejada em uma casa ou edifício.
- Meteorologia: o conceito de calor latente é relevante na meteorologia para explicar o comportamento das nuvens e a liberação de calor latente quando o vapor de água se condensa em gotas de chuva ou cristais de gelo, o que pode afetar o clima.
Em resumo, o calor latente descreve a quantidade de calor envolvida nas mudanças de fase da matéria e é essencial em várias aplicações da ciência e da engenharia, permitindo o controle e o entendimento de processos de fusão e solidificação.
Exercícios resolvidos sobre fusão
1) (UFPR) A água pode ser encontrada na natureza nos estados sólido, líquido ou gasoso. Conforme as condições, a água pode passar de um estado para outro através de processos que recebem nomes específicos. Um desses casos é quando ela muda do estado sólido para o líquido.
Assinale a alternativa que apresenta o nome correto dessa transformação.
a) Sublimação.
b) Vaporização.
c) Solidificação.
d) Condensação.
e) Fusão.
Gabarito: Alternativa E - Fusão é o nome dado à mudança de estado físico em que um sólido, ao receber energia em forma de calor, passa para o estado líquido devido ao rompimento da diminuição da coesão entre os átomos ou moléculas que o formam.
2) (Unesp-SP) Considere seus conhecimentos sobre mudanças de fase e analise as afirmações I, II e III, referentes à substância água, um recurso natural de alto valor.
I. Durante a transição de sólido para líquido, a temperatura não muda, embora uma quantidade de calor tenha sido fornecida à água.
II. O calor latente de condensação da água tem um valor diferente do calor latente de vaporização.
III. Em determinadas condições, a água pode coexistir na fase sólida, líquida e gasosa.
Pode-se afirmar que
a) apenas a afirmação I é correta.
b) apenas as afirmações I e II são corretas.
c) apenas as afirmações I e III são corretas.
d) apenas as afirmações II e III são corretas.
e) as afirmações I, II e III são corretas.
Gabarito: Alternativa C - A durante a transição de sólido para líquido a temperatura permanece constante mesmo ao continuar fornecendo calor à água, o que acontece porque nem todas as moléculas ou átomos romperam a energia de coesão que os mantém próximos no estado sólido. Isso explica o porquê de nessa etapa haver tanto água no estado sólido quanto no estado líquido.
Créditos da imagem
Fontes
ATKINS, P. Peter Atkins. New Scientist, v. 192, n. 2578, p. 64, 2006.
SAMPAIO, L. Mudanças de estado. In: Física Clássica 2. 1. ed. São Paulo: Atual Editora, 12AD. p. 76–90.
TAVARES, G. W.; PRADO, A. G. S. Educação. Química Nova, v. 33, n. 9, p. 1987–1990, 2010.


