Calor latente é a quantidade de energia térmica que é absorvida ou cedida por um corpo ou sistema termodinâmico, durante uma mudança de seu estado físico, em temperatura constante.
Quando uma substância pura atinge sua temperatura de fusão ou ebulição, durante o seu aquecimento, seu estado físico começa a mudar. Nesse processo, ela continua a absorver calor, no entanto, sua temperatura permanece constante. Isso acontece, pois, ao atingir essas temperaturas, nas quais ocorrem mudanças de estado físico, todo o calor que está sendo absorvido pelo sistema termodinâmico é utilizado para vencer a energia potencial que mantém as suas moléculas agregadas. A partir do instante que o sistema termodinâmico absorve toda a energia necessária para desagregar suas moléculas, a interação entre elas diminui, indicando que o seu estado de agregação mudou. Após a mudança de estado físico, o calor que era absorvido isotermicamente continua a ser absorvido pelas moléculas, fornecendo-lhes energia cinética. Esse tipo de calor que aumenta a energia cinética das moléculas é chamado de calor sensível.
O calor latente mede a quantidade de calor, por unidade de massa, necessária para que ocorra alguma mudança de estado físico do corpo, por isso, a sua unidade de medida, de acordo com o Sistema Internacional (SI), é o Joule por quilograma (J/kg). No entanto, o uso de outras unidades, como a caloria por grama (cal/g), é bastante comum no estudo da calorimetria.
Veja também: O que é capacidade térmica?
Tópicos deste artigo
- 1 - Tipos de calor latente
- 2 - Exemplos de calor latente
- 3 - Fórmula de calor latente
- 4 - Mudanças de fases e calor latente
- 5 - Tabela de calor latente
- 6 - Exercícios de calor latente
Tipos de calor latente
Existem dois tipos de calor: o calor sensível e o calor latente. O calor sensível é aquele que é transferido entre os corpos quando há mudanças de temperatura. O calor latente, por sua vez, ocorre quando há transferências de calor, sem que haja mudanças de temperatura.
O calor latente é altera-se para as diferentes mudanças de estado físico. Confira os diferentes tipos de calor latente:
-
Calor latente de fusão (LF): é o calor que é absorvido ou cedido pelos corpos durante o processo de fusão: do líquido para o sólido e vice-versa, com temperatura constante.
Não pare agora... Tem mais depois da publicidade ;) -
Calor latente de vaporização (LV): é aquele que é transferido durante as transformações sólido-líquido ou líquido-sólido, em temperatura constante.
Exemplos de calor latente
Confira algumas situações cotidianas em que há trocas de calor latente:
-
Quando aquecemos a água, até a temperatura de 100 ºC, ela inicia o processo de evaporação. Enquanto toda a água não se tornar vapor, sua temperatura não muda.
-
Quando jogamos água sobre uma superfície muito quente, toda a água vaporiza-se quase instantaneamente. Esse processo é chamado de calefação e envolve a absorção de calor latente.
-
Há troca de calor latente quando tocamos uma garrafa de refrigerante em baixas temperaturas e todo o seu conteúdo congela-se rapidamente em temperatura constante, graças à sua temperatura mais baixa que o ponto de fusão da água.
Fórmula de calor latente
O calor latente é calculado pela razão da quantidade de calor transferida na transformação isotérmica:
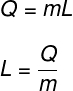
Q – quantidade de calor transferido
m – massa do corpo
L – calor latente
Mudanças de fases e calor latente
As mudanças de fases em substâncias puras ocorrem em temperatura constante, mediante a absorção ou liberação de calor latente. Todas as substâncias puras apresentam uma curva de aquecimento parecida com a da figura abaixo:
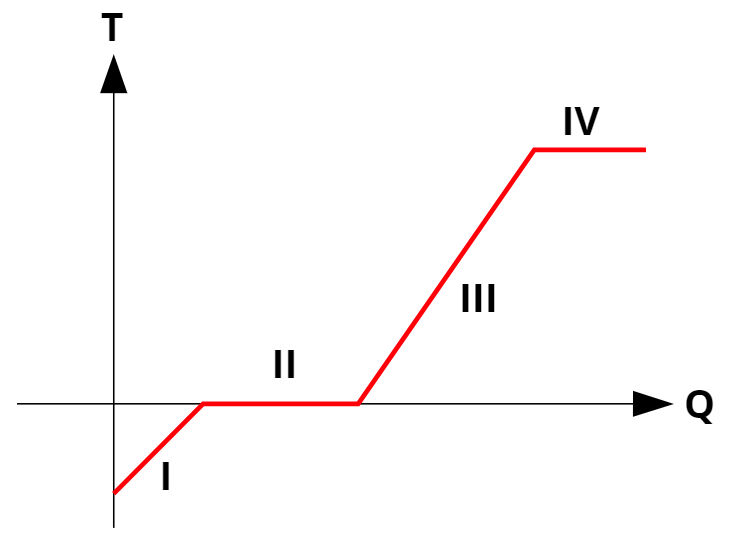
As curvas de aquecimento relacionam a temperatura (eixo y) com a quantidade de calor cedida ou recebida (eixo x). Nas mudanças de fase (processos II e IV), a temperatura permanece constante, embora ainda haja trocas de calor.
Veja também: Fundamentos da calorimetria
Tabela de calor latente
Nas condições normais de temperatura e pressão, o calor latente da água, para suas diferentes mudanças de estado físico, é mostrado na tabela abaixo:
|
Transformação |
Calor latente (cal/g) |
|
Fusão (0 ºC) |
80 |
|
Solidificação (0 ºC) |
-80 |
|
Vaporização (100 ºC) |
540 |
|
Condensação (100 ºC) |
-540 |
De acordo com a tabela mostrada acima, são necessárias 80 calorias para congelarmos 1 grama de água que se encontre na temperatura de fusão (0 ºC). Os sinais negativos nos processos de solidificação e condensação indicam que neles houve liberação de calor, portanto, essas duas transformações são exotérmicas. A tabela abaixo apresenta o calor latente em J/kg, para os mesmos processos:
|
Transformação |
Calor latente (J/kg) |
|
Fusão (0 ºC) |
333.103 |
|
Solidificação (0 ºC) |
-333.103 |
|
Vaporização (100 ºC) |
2,2.106 |
|
Condensação (100 ºC) |
-2,2.106 |

Exercícios de calor latente
1) Um recipiente armazena 500 g de água no estado líquido. Sem que haja mudanças na temperatura da água, repentinamente, todo o seu conteúdo é evaporado. Determine a quantidade de calor que foi transferida para o conteúdo desse recipiente.
Dados: LF = 540 cal/g
Resolução:
Para calcularmos a quantidade de calor necessário para a evaporação dessa massa de água, usaremos a seguinte fórmula:
![]()
Usando os dados fornecidos pelo exercício, faremos o seguinte cálculo:
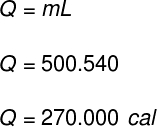
Por Me. Rafael Helerbrock



.gif)
.gif)
.gif)