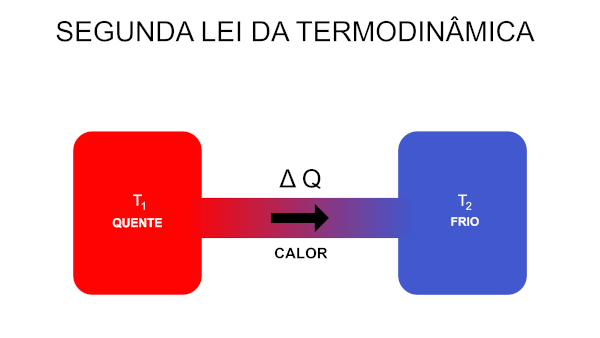
A segunda lei da termodinâmica dita quais são as condições existentes para que o calor seja convertido em trabalho nas máquinas térmicas e nos refrigeradores. Ela também aborda a definição da entropia como sendo um fenômeno capaz de medir a desorganização das partículas nos sistemas físicos.
Leia também: Calorimetria — o ramo da Física que estuda as trocas de calor
Tópicos deste artigo
- 1 - Resumo sobre a segunda lei da termodinâmica
- 2 - Qual é a segunda lei da termodinâmica?
- 3 - Aplicações da segunda lei da termodinâmica
- 4 - Entropia e a segunda lei da termodinâmica
- 5 - Fórmulas da segunda lei da termodinâmica
- 6 - Ciclo de Carnot
- 7 - Leis da termodinâmica
- 8 - Exercícios resolvidos sobre a segunda lei da termodinâmica
Resumo sobre a segunda lei da termodinâmica
-
A segunda lei da termodinâmica é representada pelos enunciados de Clausius e Kelvin-Planck.
-
O enunciado de Clausius aborda sobre o fluxo de calor ser do corpo mais quente para o corpo mais frio.
-
O enunciado de Kelvin-Planck aborda a incapacidade dos dispositivos térmicos converterem todo o seu calor em trabalho.
-
A segunda lei da termodinâmica é aplicada nas máquinas térmicas e nos refrigeradores.
-
O ciclo de Carnot é o ciclo de rendimento máximo obtido pelas máquinas térmicas.
Não pare agora... Tem mais depois da publicidade ;) -
O ciclo de Carnot possui quatro etapas, uma expansão isotérmica reversível, uma expansão adiabática reversível, uma compressão isotérmica reversível e uma compressão adiabática reversível.
-
O teorema de Carnot se refere ao rendimento das máquinas de Carnot.
Qual é a segunda lei da termodinâmica?
A segunda lei da termodinâmica é uma lei que aborda as restrições que ocorrem nos processos termodinâmicos. Foi enunciada pelos físicos Rudolf Clausius (1822-1888), Lorde Kelvin (1824-1907) e Max Planck (1858-1947), como veremos abaixo:
O físico e matemático Rudolf Clausius afirmou que o fluxo de condução de calor ocorre do corpo de temperatura mais alta para o corpo de temperatura mais baixa, sendo assim, não é natural ocorrer o processo inverso, para tanto, é necessário realizar um trabalho sobre esse sistema. Com isso, ele enunciou:
É impossível realizar um processo cujo único efeito seja transferir calor de um corpo mais frio para um corpo mais quente.|1|
Já o físico-matemático William Thomson, conhecido como lorde Kelvin, juntamente às contribuições do físico Max Planck, afirmou a impossibilidade de os dispositivos térmicos terem uma eficiência de 100%, pois sempre haverá perda de calor.
Aplicações da segunda lei da termodinâmica
A segunda lei da termodinâmica é aplicada nas máquinas térmicas e nos refrigeradores.
-
Segunda lei da termodinâmica nas máquinas térmicas
As máquinas térmicas são capazes de converter o calor em trabalho. Uma fonte quente fornece calor para a máquina térmica, que o transforma em trabalho. O restante do calor ela envia para a fonte fria, como descrito na imagem abaixo:
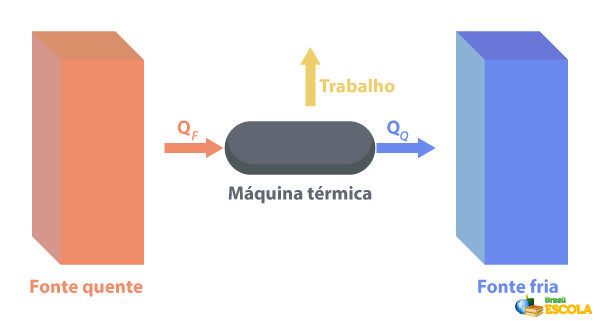
Alguns exemplos de máquinas térmicas são: as turbinas a vapor e a querosene dos aviões a jato, os motores de combustão, os reatores termonucleares.
-
Segunda lei da termodinâmica em refrigeradores
Os refrigeradores são máquinas que funcionam pelo processo inverso ao das máquinas térmicas, em que eles removem o calor de uma região com temperatura mais baixa e o fornecem a uma região com temperatura mais elevada. Como isso não é natural, é necessário que a máquina realize trabalho utilizando a energia elétrica, como descrito na imagem abaixo:
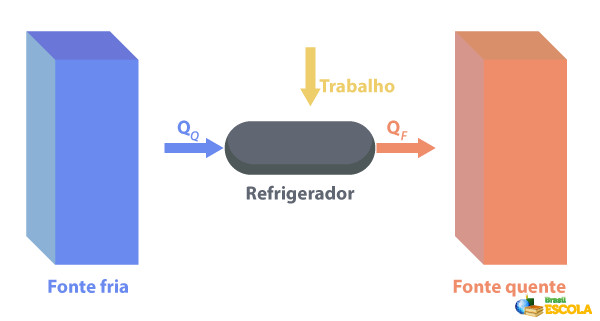
Alguns exemplos de refrigeradores são as geladeiras e os ares-condicionados.
Entropia e a segunda lei da termodinâmica
A segunda lei da termodinâmica propõe a existência da entropia, uma grandeza física responsável por mensurar o grau de desorganização das partículas em um sistema físico ou o grau de irreversibilidade dos processos termodinâmicos envolvidos nas máquinas térmicas, tratando-se de um fenômeno espontâneo, inevitável, irreversível e expansivo. Com isso, só é possível sua observação e contenção do grau de volatilidade dos processos. À medida que a entropia é aumentada, o grau de desordem do sistema também cresce.
A nomenclatura entropia tem origem grega e significa “transformação”, “mudança”, sendo assim utilizada na Física para indicar aleatoriedade e desordem. A entropia pode ser calculada por meio da fórmula:
\(∆S=\frac{∆U}T\)
-
\(∆S\) é a variação de entropia, medida em [J/K].
-
\(∆U\) é a variação de energia interna, medida em Joule .
-
T é a temperatura, medida em Kelvin .
Do ponto de vista estatístico, a entropia é calculada pela fórmula:
\(S=k\cdot ln\ Ω\)
-
S é a entropia, medida em [J/K].
-
k é a constante de Boltzmann, vale \(1,4\cdot 10^{-23}\ J/K\).
-
Ω é número de microestados possíveis para o sistema.
Leia também: Processos de propagação de calor
Fórmulas da segunda lei da termodinâmica
-
Máquinas térmicas e refrigeradores
\(Q_Q=W+Q_F\)
-
\(Q_Q\) é o calor da fonte quente, medido em Joule .
-
W é o trabalho realizado pela máquina térmica, medido em Joule .
-
\(Q_F\) é o calor da fonte fria, medido em Joule .
Pode ser representada por:
\(W=Q_Q-Q_F\)
-
W é o trabalho realizado pela máquina térmica, medido em Joule .
Não pare agora... Tem mais depois da publicidade ;) -
\(Q_Q\) é o calor da fonte quente, medido em Joule .
-
\(Q_F\) é o calor da fonte fria, medido em Joule .
-
Refrigeradores
\(η=\frac{Q_F}{Q_Q-Q_F}\)
-
\(η\) é o rendimento do refrigerador.
-
\(Q_F\) é o calor da fonte fria, medido em Joule .
-
\(Q_Q\) é o calor da fonte quente, medido em Joule .
Não pare agora... Tem mais depois da publicidade ;)
Pode ser representada como:
\(η=\frac{Q_F}W\)
-
\(η\) é o rendimento do refrigerador.
-
\(Q_F\) é o calor da fonte fria, medido em Joule .
-
W é o trabalho realizado pela máquina térmica, medido em Joule .
-
Exemplos de aplicações das fórmulas
Exemplo 1: Calcule o trabalho que uma máquina térmica faz durante um ciclo que recebe 500 J de calor da fonte quente e transfere apenas 400 J para a fonte fria.
Para calcular o trabalho de uma máquina térmica, usaremos a fórmula:
\(W=Q_Q-Q_F\)
Substituindo os valores indicados no enunciado:
\(W=500-400\)
\(W=100\ J\)
O trabalho da máquina térmica foi de 100 Joules.
Exemplo 2: Qual o rendimento de um refrigerador que recebe 150 J de calor na fonte quente e transfere para a fonte fria 50 J de calor?
Para calcular o rendimento de um refrigerador, usaremos a fórmula:
\(η=\frac{Q_F}{Q_Q-Q_F}\)
Substituindo o valores dados no enunciado, obtemos:
\(η=\frac{50}{150-50}\)
\(η=\frac{50}{100}\)
\(η=0,5\)
Multiplicando o rendimento por 100%:
\(η=0,5\cdot100%\)
\(η=50\%\)
O refrigerador possui um rendimento de 50%.
Ciclo de Carnot
O ciclo de Carnot foi desenvolvido pelo cientista Sadi Carnot (1796-1832), com o objetivo de identificar o máximo rendimento que pode ser atingido por um motor térmico que opera entre uma fonte quente e uma fonte fria.
Com base em seus estudos, Carnot identificou que, para que se obtenha o máximo rendimento de uma máquina térmica, é necessário que o seu processo seja reversível, assim, ele desenvolveu o ciclo de rendimento máximo intitulado ciclo de Carnot, e a máquina térmica que funciona por meio dele é chamada de máquina térmica de Carnot. Como o ciclo de Carnot é reversível, então ele pode ser invertido, desse modo, foram desenvolvidos os refrigeradores.
O ciclo de Carnot, independentemente da substância utilizada, é composto de quatro processos descritos no gráfico da pressão pelo volume (p×V), como podemos ver na imagem abaixo:
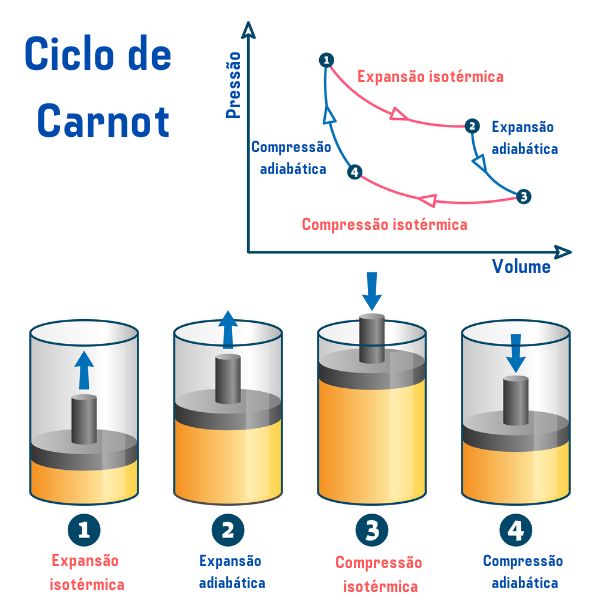
-
1º processo, do ponto 1 → 2: ocorre uma expansão isotérmica (processo em que a temperatura se mantém constante) reversível, em que o gás (ou sistema) realiza trabalho e adquire uma quantidade de calor da fonte quente.
-
2º processo, do ponto 2 → 3: ocorre uma expansão adiabática (processo em que há trocas de calor com o meio externo) reversível, em que não acontece troca de calor com as fontes térmicas, mas o gás realiza trabalho e há diminuição da sua energia interna, ocasionando diminuição da temperatura.
-
3º processo, do ponto 3 → 4: ocorre uma compressão isotérmica reversível, em que o gás recebe trabalho e cede uma quantidade de calor à fonte fria.
-
4º processo, do ponto 4 → 1: ocorre uma compressão adibática reversível, em que não acontece troca de calor com as fontes térmicas e o gás é aquecido até atingir a temperatura da fonte quente, e assim ser colocado em contato com ela, finalizando o ciclo.
Não pare agora... Tem mais depois da publicidade ;)
Leis da termodinâmica
As leis da termodinâmica são quatro leis que regem todo o estudo da termodinâmica, estudam as relações existentes entre o volume, a temperatura e a pressão e outras grandezas físicas, como o calor e energia.
-
Lei zero da termodinâmica: é a lei do equilíbrio térmico, ela estuda a troca de calor entre corpos que apresentam diferentes temperaturas.
-
Primeira lei da termodinâmica: é a lei da conservação da energia nos sistemas termodinâmicos, ela estuda a transformação do calor em trabalho e/ou energia interna.
-
Segunda lei da termodinâmica: é a lei que trata das máquinas térmicas, dos refrigeradores e da entropia.
-
Terceira lei da termodinâmica: é a lei do zero absoluto, ela estuda os efeitos dessa temperatura.
Leia também: Rendimento das máquinas térmicas
Exercícios resolvidos sobre a segunda lei da termodinâmica
Questão 1 Determine a temperatura da fonte quente de uma máquina de Carnot, sabendo que a temperatura da fonte fria é de 450 K e seu rendimento é de 80%.
a) 2250 K
b) 450 K
c) 1500 K
d) 900 K
e) 3640 K
Resolução:
Alternativa A. Calcularemos a temperatura da fonte quente com base na fórmula de rendimento de uma máquina de Carnot:
\(η=1-\frac{T_F}{T_Q} \)
\(80 \%=1-\frac{450}{T_Q} \)
\(\frac{80}{100}=1-\frac{450}{T_Q} \)
\(0,8=1-\frac{450}{T_Q} \)
\(0,8-1=-\frac{450}{T_Q} \)
\(-0,2=-\frac{450}{T_Q} \)
\(0,2=\frac{450}{T_Q} \)
\(T_Q=\frac{450}{0,2}\)
\(T_Q=2250\ K\)
Questão 2 (Cefet-PR) O 2° princípio da termodinâmica pode ser enunciado da seguinte forma: “É impossível construir uma máquina térmica operando em ciclos, cujo único efeito seja retirar calor de uma fonte e convertê-lo integralmente em trabalho”. Por extensão, esse princípio nos leva a concluir que:
a) sempre se pode construir máquinas térmicas cujo rendimento seja 100%.
b) qualquer máquina térmica necessita apenas de uma fonte quente.
c) calor e trabalho não são grandezas homogêneas.
d) qualquer máquina térmica retira calor de uma fonte quente e rejeita parte desse calor para uma fonte fria.
e) somente com uma fonte fria, mantida sempre a 0 °C, seria possível a uma certa máquina térmica converter integralmente calor em trabalho.
Resolução:
Alternativa D. Esse princípio nos informa que é impossível retirar todo o calor da fonte quente e transferi-lo para a fonte fria.
Nota
|1| Curso de física básica: Fluidos, Oscilações e Ondas, Calor (vol. 2).
Por Pâmella Raphaella Melo
Professora de Física