A sublimação é uma mudança de estado físico da matéria caracterizada pela passagem direta da fase sólida para a fase gasosa, sem passar pela fase líquida. A rigor, toda substância pode sofrer sublimação, porém em condições específicas de pressão e temperatura. A sublimação tem correlação com a pressão de vapor na fase sólida, bem como com as interações intermoleculares exercidas pelos sólidos.
Esse processo pode ser observado facilmente em um pedaço de gelo seco, que consiste em gás carbônico sólido. O gás carbônico sublima em pressão e temperatura ambiente. O processo contrário à sublimação pode ser chamado de ressublimação ou deposição. Para que ocorra sublimação, a matéria deve absorver energia, por isso é considerada um processo endotérmico.
Leia também: Quais são os estados físicos da matéria?
Tópicos deste artigo
- 1 - Resumo sobre sublimação
- 2 - O que é sublimação?
- 3 - Funcionamento da sublimação
- 4 - Exemplos de sublimação
- 5 - Exercícios resolvidos sobre sublimação
Resumo sobre sublimação
-
A sublimação é a passagem direta da fase sólida para a fase gasosa, sem passar pela fase líquida.
-
São necessárias condições específicas de pressão e temperatura para se observar a sublimação de uma substância.
-
A sublimação é influenciada por aspectos termodinâmicos, como a pressão de vapor na fase sólida e as interações intermoleculares.
-
A sublimação é um processo endotérmico.
Não pare agora... Tem mais depois da publicidade ;) -
Um exemplo de sublimação é o que ocorre no gelo seco, que consiste em dióxido de carbono sólido.
O que é sublimação?
A sublimação é a transição direta da fase sólida para a fase gasosa, sem passar pela fase líquida. Ela ocorre em condições específicas de temperatura e pressão para alguns sólidos. Essa transição é um processo físico de mudança de estado, não envolvendo reações químicas.
O processo contrário, ou seja, a passagem direta da fase gasosa para a fase sólida é chamada de diversas formas. Alguns autores mantêm a palavra sublimação para essa mudança de fase, enquanto outros utilizam “ressublimação” e até mesmo “deposição”.
Funcionamento da sublimação
Pode-se fazer um paralelo entre a sublimação e a evaporação. Em ambos os casos, o ponto final é fase gasosa. A diferença, obviamente, está na fase de partida: sólido para sublimação e líquido para evaporação.
Em ambos os casos, há influência da pressão de vapor e também de aspectos termodinâmicos, envolvendo calor e interações intermoleculares.
-
O que é a pressão de vapor?
Em um recipiente fechado contendo um líquido, é possível perceber que existe um equilíbrio entre a fase líquida e a fase vapor. Isso ocorre porque, mesmo abaixo da temperatura de ebulição, a energia presente é suficiente para que algumas moléculas do líquido se desprendam e passem para o vapor. Contudo, algumas moléculas do vapor também podem se condensar novamente e retornarem à fase líquida, o que demonstra a reversibilidade do processo.
Esse vapor, por ser feito de matéria (possui massa e volume), exerce pressão sobre a superfície do líquido, conhecida como pressão de vapor. Ela é dependente não da quantidade de líquido, mas sim da temperatura, pois quanto maior a temperatura, mais facilmente as moléculas se desprendem da fase líquida.
Líquidos que possuem uma alta pressão de vapor em temperaturas comuns são chamados de voláteis. Por exemplo, a 25 °C, o éter etílico possui uma pressão de vapor de 0,58 atm, a acetona (propanona) tem 0,29 atm de pressão de vapor, enquanto a água possui uma pressão de vapor de 0,023 atm. Aliás, quando a pressão de vapor é idêntica à pressão atmosférica, o líquido entra em ebulição.
-
Pressão de vapor e sublimação
Embora em menor proporção, sólidos também apresentam pressão de vapor, porém bem menor que dos líquidos. Por exemplo, mesmo na temperatura de 1000 K, a pressão de vapor do ferro é de apenas 9,21 x 10-20 atm. Porém, alguns sólidos conseguem sofrer sublimação, como o iodo, apresentando uma maior pressão de vapor em temperaturas normais (4 x 10-4 atm).
Isso é possível apenas com a passagem das moléculas do estado sólido diretamente para o estado gasoso. Para que isso aconteça, as moléculas do sólido devem apresentar interações intermoleculares fracas (no iodo, por exemplo, são do tipo dipolo induzido-dipolo induzido).
Vê-se, ainda, que o processo de sublimação é endotérmico, ou seja, há necessidade de as moléculas do sólido absorverem energia na forma de calor para que assim possam romper as interações intermoleculares e passar para o estado de vapor. A quantidade de calor envolvida pode ser medida por uma grandeza termodinâmica, conhecida como entalpia de sublimação.
-
Diagrama de fases
Para se saber em qual faixa de pressão e temperatura ocorrerá a sublimação de um sólido, é necessário fazer a avaliação de seu diagrama de fases. Observemos o caso do dióxido de carbono, CO2.
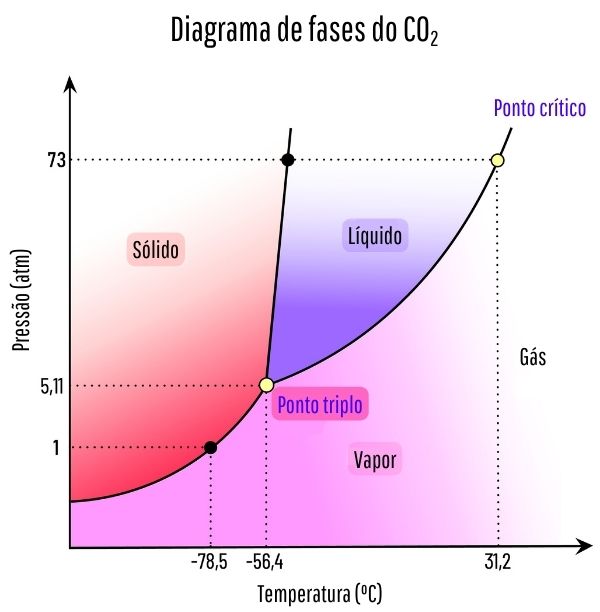
Em um diagrama de fases, as linhas de fronteira entre os estados (sólido, líquido e gasoso) reúnem os valores de pressão e temperatura para ocorrer uma mudança de estado. Ao observar o caso do CO2, percebe-se que em 1 atmosfera de pressão, a fase sólida passa diretamente para a fase vapor em uma temperatura de -78,5 °C, o que caracteriza uma sublimação.
O dióxido de carbono só apresenta fase líquida em pressões acima de 5,11 atmosfera, e a partir dessa pressão, não é mais possível haver sublimação.
Exemplos de sublimação
-
Gelo seco: o gelo seco, muito usado para fazer efeitos de neblina em festas e eventos, é, na verdade, o dióxido de carbono no estado sólido.

-
Naftalina: as pedrinhas de naftalina são feitas de naftaleno, um composto orgânico aromático. É aplicada para retirar odores ruins e também espantar traças, baratas e outros animais peçonhentos, por isso é comum que sejam usadas em armários ou até mesmo mictórios.

-
Cânfora: de odor característico, as pedrinhas de cânfora também podem sofrer sublimação. Também servem para espantar mosquitos e evitar o mofo.

-
Iodo: o ametal pertencente aos halogênios também apresenta sublimação.
Não pare agora... Tem mais depois da publicidade ;)

Contudo, dentre as substâncias apresentadas, apenas o dióxido de carbono apresenta sublimação em condições ambiente. Os demais, mesmo apresentando sublimação, podem sofrer fusão normal na pressão em que vivemos.
Leia também: Plasma — o quarto estado da matéria
Exercícios resolvidos sobre sublimação
Questão 1
(Fuvest 2020) Em supermercados, é comum encontrar alimentos chamados de liofilizados, como frutas, legumes e carnes. Alimentos liofilizados continuam próprios para consumo após muito tempo, mesmo sem refrigeração. O termo “liofilizado”, nesses alimentos, refere‐se ao processo de congelamento e posterior desidratação por sublimação da água. Para que a sublimação da água ocorra, é necessária uma combinação de condições, como mostra o gráfico de pressão por temperatura, em que as linhas representam transições de fases.
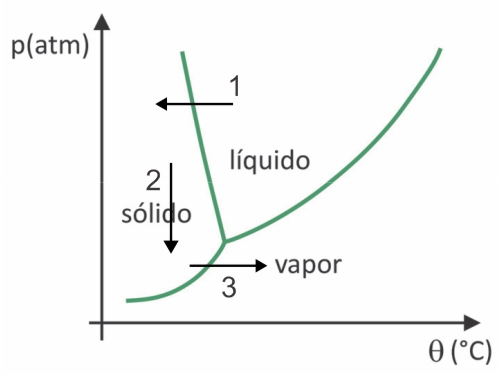
Apesar de ser um processo que requer, industrialmente, uso de certa tecnologia, existem evidências de que os povos pré-colombianos que viviam nas regiões mais altas dos Andes conseguiam liofilizar alimentos, possibilitando estocá‐los por mais tempo. Assinale a alternativa que explica como ocorria o processo de liofilização natural:
a) A sublimação da água ocorria devido às baixas temperaturas e à alta pressão atmosférica nas montanhas.
b) Os alimentos, após congelados naturalmente nos períodos frios, eram levados para a parte mais baixa das montanhas, onde a pressão atmosférica era menor, o que possibilitava a sublimação.
c) Os alimentos eram expostos ao Sol para aumentar a temperatura, e a baixa pressão atmosférica local favorecia a solidificação.
d) As temperaturas eram baixas o suficiente nos períodos frios para congelar os alimentos, e a baixa pressão atmosférica nas altas montanhas possibilitava a sublimação.
e) Os alimentos, após congelados naturalmente, eram prensados para aumentar a pressão, de forma que a sublimação ocorresse.
Resposta: Letra D.
Na liofilização, há o congelamento da água com sua posterior sublimação. Os povos pré-colombianos podiam realizar tal processo, pois no inverno a água poderia congelar (seta 1) e, com as baixas pressões (seta 2) da regiões mais altas dos Andes, ela poderia sofrer sublimação (seta 3).
Questão 2
(Uerj 2005) O gelo seco, ou dióxido de carbono solidificado, muito utilizado em processos de refrigeração, sofre sublimação nas condições ambientes. Durante essa transformação, ocorrem, dentre outros, os fenômenos de variação de energia e de rompimento de interações.
Esses fenômenos são classificados, respectivamente, como:
a) exotérmico - interiônico
b) exotérmico - internuclear
c) isotérmico - interatômico
d) endotérmico - intermolecular
Resposta: Letra D.
A sublimação é um processo endotérmico, pois exige absorção de calor para romper as interações que mantêm as moléculas da fase sólida compactadas. Essas interações são do tipo intermolecular.
Por Stéfano Araújo Novais
Professor de Química

