A Primeira Lei da Termodinâmica é uma aplicação do princípio da conservação da energia para os sistemas termodinâmicos. De acordo com essa lei, a variação da energia interna de um sistema termodinâmico equivale à diferença entre quantidade de calor absorvido pelo sistema e o trabalho por ele realizado.
Veja também: Conceitos fundamentais e resumo sobre Termologia
Tópicos deste artigo
- 1 - Qual é a Primeira Lei da Termodinâmica?
- 2 - Fórmula da Primeira Lei da Termodinâmica
- 3 - Variação da energia interna
- 4 - Calor
- 5 - Exercícios resolvidos
Qual é a Primeira Lei da Termodinâmica?
A Primeira Lei da Termodinâmica é uma consequência direta do princípio de conservação da energia. De acordo com esse princípio, a energia total de um sistema sempre se mantém constante, já que ela não é perdida, mas sim, transformada.
No âmbito da Termodinâmica, utilizam-se noções mais específicas e menos genéricas que aquelas usadas no princípio da conservação da energia. Na Primeira Lei da Termodinâmica, usamos conceitos como energia interna, calor e trabalho, que são pertinentes ao âmbito das máquinas térmicas (aplicações tecnológicas de fundamental importância para a Termodinâmica).

Imagine uma máquina movida a vapor, quando o fluido de trabalho dessa máquina (o vapor d'água) recebe calor de uma fonte externa, duas conversões de energia são possíveis: o vapor pode ter a sua temperatura acrescida em alguns graus ou, ainda, pode expandir-se e mover os pistões dessa máquina, realizando, assim, certa quantidade de trabalho.
“A variação da energia interna de um sistema termodinâmico corresponde à diferença entre a quantidade de calor por ele absorvida e a quantidade de trabalho que esse sistema realiza.”
Fórmula da Primeira Lei da Termodinâmica
A fórmula usada para descrever matematicamente a Primeira Lei da Termodinâmica é mostrada a seguir:
![]()
ΔU – variação de energia interna (cal ou J)
Q – calor (cal ou J)
τ – trabalho (cal ou J)
Para usarmos essa fórmula, precisamos nos atentar para algumas regras de sinais:
-
ΔU – será positivo, se a temperatura do sistema aumentar;
-
ΔU – será negativo, se a temperatura do sistema diminuir;
Não pare agora... Tem mais depois da publicidade ;) -
Q – será positivo, se o sistema absorver calor do meio externo;
-
Q – será negativo, se o sistema ceder calor ao meio externo;
-
τ – será positivo, se o sistema se expandir, realizando trabalho sobre o meio externo;
-
τ – será negativo, se o sistema se contrair, recebendo trabalho do meio externo.
Variação da energia interna
O termo ΔU refere-se à mudança de energia atribuída à energia cinética das partículas constituintes do sistema, no caso de um gás ideal, pode-se dizer que ΔU equivale a:
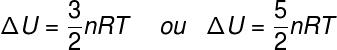
n – número de mols (mol)
R – constante universal dos gases ideais (0,082 atm.l/mol.K ou 8,31 J/mol.K)
T – temperatura absoluta (kelvin)
Analisando as fórmulas, pode-se perceber que, caso não ocorra uma mudança de temperatura no sistema, sua energia interna também permanecerá inalterada. Além disso, é importante dizer que para as máquinas térmicas, que operam em ciclos, a variação da energia interna, ao final de cada ciclo, deve ser nula, pois nesse ponto, o motor volta a operar com a temperatura inicial.
Veja também: Rendimento das máquinas térmicas: como se calcula?
Calor
Seguindo para o próximo termo, Q, que se refere à quantidade de calor transferida para o sistema, costumamos utilizar a equação fundamental da calorimetria, mostrada a seguir:
![]()
Q -calor (cal ou J)
m – massa (g ou kg)
c – calor específico (cal/gºC ou J/kg.K)
ΔT – variação de temperatura (celsius ou kelvin)
Trabalho
A última das grandezas relacionadas à Primeira Lei da Termodinâmica é o trabalho (τ), que tem uma fórmula analítica apenas para as transformações que ocorrem sob pressão constante, também conhecidas como transformações isobáricas, observe:
![]()
P – pressão (Pa ou atm)
ΔV – variação de volume (m³ ou l)
Quando a pressão exercida sobre o sistema não for constante, o trabalho poderá ser calculado pela área do gráfico de pressão em função do volume (P x V). Para saber mais sobre essa grandeza escalar, acesse: trabalho.
Exercícios resolvidos
Questão 1) (Cefet MG) O trabalho realizado em um ciclo térmico fechado é igual a 100 J e, o calor envolvido nas trocas térmicas é igual a 1000 J e 900 J, respectivamente, com fontes quente e fria.
A partir da Primeira Lei da Termodinâmica, a variação da energia interna nesse ciclo térmico, em joules, é
a) 0
b) 100
c) 800
d) 900
e) 1000
Resolução
Alternativa a.
Vamos resolver o exercício utilizando a Primeira Lei da Termodinâmica, observe:
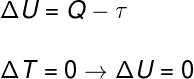
De acordo com o enunciado, pede-se que calculemos a variação de energia interna em um ciclo termodinâmico fechado, nesse caso, sabemos que a variação de energia interna deve ser nula, já que a máquina voltará a operar com a mesma temperatura em que se encontrava no início do ciclo.
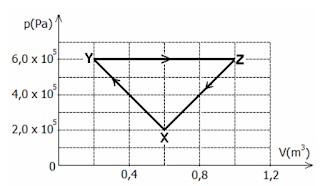
Questão 2) (Upf) Uma amostra de um gás ideal se expande duplicando o seu volume durante uma transformação isobárica e adiabática. Considerando que a pressão experimentada pelo gás é 5.106 Pa e seu volume inicial 2.10-5 m³, podemos afirmar:
a) O calor absorvido pelo gás durante o processo é de 25 cal.
b) O trabalho efetuado pelo gás durante sua expansão é de 100 cal.
c) A variação de energia interna do gás é de –100 J.
d) A temperatura do gás se mantém constante.
e) Nenhuma das anteriores.
Resolução
Alternativa c.
Usando informações fornecidas pelo enunciado do exercício, utilizaremos a Primeira Lei da Termodinâmica para encontrar a alternativa correta:
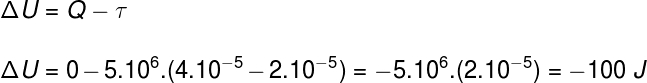
Questão 3) (Ufu) Um botijão de cozinha contém gás sob alta pressão. Ao abrirmos esse botijão, percebemos que o gás escapa rapidamente para a atmosfera. Como esse processo é muito rápido, podemos considerá-lo como um processo adiabático.
Considerando que a Primeira Lei da Termodinâmica é dada por ΔU = Q - W, onde ΔU é a variação da energia interna do gás, Q é a energia transferida na forma de calor e W é o trabalho realizado pelo gás, é correto afirmar que:
a) A pressão do gás aumentou e a temperatura diminuiu.
b) O trabalho realizado pelo gás foi positivo e a temperatura do gás não variou.
c) O trabalho realizado pelo gás foi positivo e a temperatura do gás diminuiu.
d) A pressão do gás aumentou e o trabalho realizado foi negativo.
Resolução
Alternativa c.
Uma vez que ocorre expansão do volume do gás, dizemos que o trabalho realizado foi positivo, ou seja, o próprio gás realizou trabalho sobre o meio externo. Além disso, uma vez que o processo ocorre muito rapidamente, não há tempo para que o gás troque calor com as vizinhanças, dessa maneira ocorre o seguinte:
![]()
De acordo com o cálculo, a energia interna do gás diminui em uma quantidade igual ao trabalho realizado pelo gás, além disso, uma vez que há diminuição da energia interna do gás, também há diminuição de temperatura.
Questão 4) (Udesc) Em um laboratório de física são realizados experimentos com um gás que, para fins de análises termodinâmicas, pode ser considerado um gás ideal. Da análise de um dos experimentos, em que o gás foi submetido a um processo termodinâmico, concluiu-se que todo calor fornecido ao gás foi convertido em trabalho.
Assinale a alternativa que representa corretamente o processo termodinâmico realizado no experimento.
a) processo isovolumétrico
b) processo isotérmico
c) processo isobárico
d) processo adiabático
e) processo composto: isobárico e isovolumétrico
Resolução
Alternativa b.
Para que todo o calor fornecido a um gás seja convertido em trabalho, é necessário que não haja absorção de energia interna por ele, em outras palavras, o gás precisa passar por um processo isotérmico, ou seja, um processo que ocorre em temperatura constante.
Por Rafael Helerbrock
Professor de Física