No estudo dos gases ideais vemos que um gás é composto por átomos e moléculas, que se movem de acordo com as leis estabelecidas pela cinemática. Em um gás, suas partículas normalmente estão muito distantes uma das outras, tendo o vazio entre si. Vemos também que a principal característica dos gases é de praticamente só existir interação entre suas partículas quando elas colidem umas com as outras.
Com relação à Lei dos Gases Ideais, podemos dizer que ela nos mostra a relação entre pressão, volume, temperatura e número de mols. Essa relação é obtida a partir de um modelo simples para os gases, que permite determinar a relação entre grandezas macroscópicas a partir do estudo do movimento de átomos e moléculas. A teoria cinética dos gases se baseia em quatro postulados:
1 – o gás é formado por moléculas que se encontram em movimento desordenado e permanente. Cada molécula pode ter velocidade diferente das demais.
2 – cada molécula do gás interage com as outras somente por meio de colisões (forças normais de contato). A única energia das moléculas é a energia cinética.
3 – todas as colisões entre as moléculas e as paredes do recipiente que contém o gás são perfeitamente elásticas. A energia cinética total se conserva, mas a velocidade de cada molécula pode mudar.
4 – as moléculas são infinitamente pequenas. A maior parte do volume ocupado por um gás é espaço vazio.
Partindo desses postulados, Boltzmann e Maxwell mostram que a energia cinética média do total de moléculas de um gás ideal é proporcional à temperatura conforme a expressão:
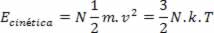
Onde k é a constante de Boltzmann e N é o número de moléculas. O valor de k pode ser calculado a partir da constante dos gases R e do número de Avogadro NA por
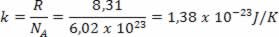
A expressão obtida mostra que a temperatura é proporcional à energia cinética média das moléculas de um gás ideal. Assim, vemos que a temperatura é uma média do grau de agitação das moléculas de um gás. Usando o número de mols, temos:
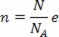
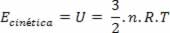
Por Domiciano Marques
Graduado em Física
