Joseph Lous Gay-Lussac (1778-1850) foi um cientista que fez estudos importantes sobre os gases. Ele realizou a produção da água a partir da reação entre os gases hidrogênio e oxigênio e verificou que eles sempre reagiam na proporção de dois volumes de hidrogênio para um volume de oxigênio, produzindo dois volumes de água:
Hidrogênio + Oxigênio → Água
1º Experimento: 2 L 1 L 2 L
2º Experimento: 4 L 2 L 4 L
3º Experimento: 8 L 4 L 8 L
4º Experimento: 16 L 8 L 160 L
Observe que em todos os experimentos a proporção é sempre a mesma: 2 : 1 : 2.
Depois de vários experimentos e análises, percebendo que o mesmo ocorria com outros tipos de reações entre gases, ou seja, as reações sempre seguiam uma proporção de volumes constantes, esse cientista chegou à seguinte lei das reações em volumes gasosos, conhecida como Lei Volumétrica de Gay-Lussac ou Lei da Combinação de Volumes:

Enunciado da lei volumétrica de Gay-Lussac
Mas essa lei foi de encontro com a teoria atômica de Dalton, que dizia que tudo era formado por partículas esféricas maciças e indivisíveis, os átomos. Segundo essa teoria, o volume dos produtos na reação deveria ser igual à soma dos volumes dos reagentes. Assim, deveria ocorrer o seguinte:
Hidrogênio + Oxigênio → Água
2 volumes + 1 volume → 3 volumes
Mas Gay-Lussac mostrou que não era assim que ocorria na prática, o resultado era igual a dois volumes de vapor de água.
A resposta para essa aparente contradição veio por meio da hipótese ou lei de Avogadro.

Selo impresso na Itália mostra Amedeo Avogadro e o enunciado de sua lei, em 1956*
Amedeo Avogadro (1776-1856) mostrou que, na realidade, os gases não eram átomos isolados, mas sim moléculas (com exceção dos gases nobres). Sua lei dizia o seguinte:

Enunciado da lei de Avogadro
Avogadro mostrou que 1 mol de qualquer gás possui 6,02 . 1023 moléculas. Esse valor é conhecido como número ou constante de Avogadro. Ficou comprovado que, nas Condições Normais de Temperatura e Pressão (CNTP), em que a pressão é igual a 1 atm e a temperatura é de 273 K (0ºC), o volume ocupado por 1 mol de qualquer gás sempre será 22,4 L. Esse valor corresponde ao volume molar dos gases. Essas relações são muito importantes para a resolução de exercícios de estequiometria.
Isso pode parecer estranho, pois pode surgir a seguinte dúvida: Como gases com moléculas e átomos de tamanhos diferentes poderiam ocupar o mesmo volume?
Bem, isso ocorre porque as moléculas dos gases ficam muito distantes umas das outras, tanto que o tamanho das moléculas é desprezível.
Desse modo, a lei volumétrica de Avogadro explicou a lei volumétrica de Gay-Lussac. Observe a seguir que duas moléculas de hidrogênio (dois volumes) reagem com uma molécula de oxigênio (um volume) para a formação de duas moléculas de água (dois volumes). A água e o hidrogênio possuem o mesmo volume porque possuem a mesma quantidade de moléculas, conforme dito pela lei de Avogadro.
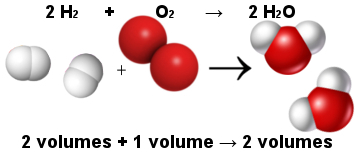
Proporção entre moléculas na reação de formação da água
Ao mesmo tempo, a lei de Avogadro fez com que a teoria atômica permanecesse, pois veja que tanto nos reagentes quanto nos produtos há um total de 6 átomos (4 de hidrogênio e 2 de oxigênio).
Essas leis volumétricas foram muito importantes para o desenvolvimento do conceito de moléculas.
* Imagem com direitos autorais: rook76 / Shutterstock.com
Por Jennifer Fogaça
Graduada em Química



