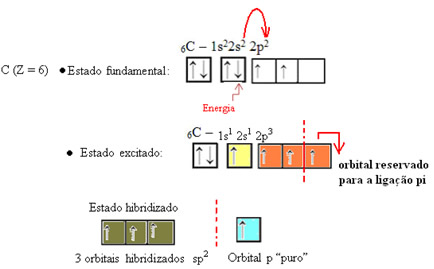
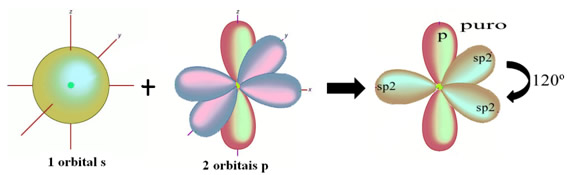
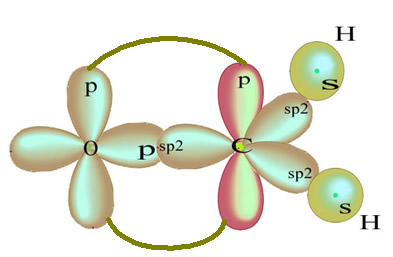
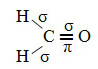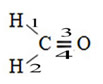Hibridização do tipo sp2
A hibridização do tipo sp2 ocorre com átomos de carbono que estabelecem uma ligação dupla.

Videoaulas

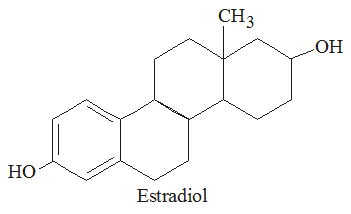
O Estradiol é um hormônio produzido pelo organismo feminino e apresenta a seguinte fórmula estrutural:
Trata-se de um hormônio esteróide de fundamental importância no desenvolvimento dos caracteres sexuais femininos e na própria fisiologia da reprodução humana.
A partir da análise da estrutura do estradiol, podemos afirmar que nela temos a presença de quantos carbonos com hibridização sp2?
a) 4
b) 5
c) 6
d) 7
e) 8
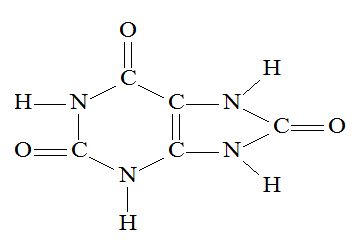
(Uece) “Gota” é uma doença caracterizada pelo excesso de ácido úrico no organismo. Normalmente, nos rins, o ácido úrico é filtrado e segue para a bexiga, de onde será excretado pela urina. Por uma falha nessa filtragem ou por um excesso de produção, os rins não conseguem expulsar parte do ácido úrico. Essa porção extra volta para a circulação, permanecendo no sangue. A molécula do ácido úrico, abaixo, é um composto que:
a) possui o anel aromático em sua estrutura.
b) apresenta quatro ligações π (pi) e treze ligações σ (sigma).
c) é caracterizado por carbonos que apresentam hibridização sp2.
d) apresenta a cadeia carbônica cíclica com dois radicais.
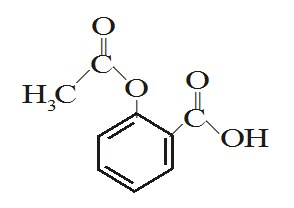
(PUC-RJ) Observe a fórmula estrutural da aspirina, mostrada abaixo:
Pode-se afirmar que a aspirina contém:
a) 2 carbonos sp2 e 1 carbono sp3
b) 2 carbonos sp2 e 7 carbonos sp3
c) 8 carbonos sp2 e 1 carbono sp3
d) 2 carbonos sp2, 1 carbono sp3 e 6 carbonos sp
e) 2 carbonos sp2, 1 carbono sp e 6 carbonos sp3