Segundo o modelo de orbitais criado por Linus Pauling, em 1960, a ligação covalente que forma as moléculas se dá pela fusão ou interpenetração dos orbitais incompletos dos elementos envolvidos na ligação. Desse modo, conclui-se que se o elemento possui um orbital incompleto (com apenas um elétron), ele poderá realizar apenas uma ligação covalente. Já se ele tiver dois orbitais incompletos, poderá fazer no máximo duas ligações e assim sucessivamente.
Entretanto, veja os orbitais atômicos do átomo do elemento carbono, que possui o número atômico igual a 6 (Z = 6):
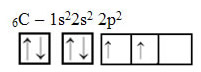
Observe que ele possui dois orbitais incompletos, portanto ele deveria realizar apenas duas ligações no máximo. Porém, não é isso que ocorre com ele. Conforme é de conhecimento de muitos, o carbono faz quatro ligações (é tetravalente), de modo que esse modelo dos orbitais não explica o caso do carbono.
Para acabar com esse impasse, foi criada uma nova teoria que explicava melhor essa questão: a Teoria da Hibridização.

Isso significa que hibridização é uma “mistura” de orbitais puros.
Para o carbono existem três tipos de hibridização, que são: sp3, sp2 e sp.
Para entender como a hibridização ocorre, vejamos o primeiro tipo de hibridização do carbono, o tipo sp3:
Esse tipo de hibridização ocorre na molécula do metano (CH4). Observe que são quatro ligações covalentes idênticas entre o carbono, que é o elemento central, e quatro hidrogênios. Assim, veja qual é o orbital incompleto do hidrogênio:
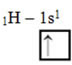
Como cada hidrogênio possui um orbital do tipo s incompleto, é necessário receber mais um elétron, ou seja, cada um realiza apenas uma ligação covalente com o carbono. Por isso o carbono precisa estar com quatro orbitais incompletos. Como isso ocorre? Por meio da hibridização.
Quando um elétron do orbital 2s absorve energia, ele passa para o orbital 2p que está vazio. Assim, dizemos que esse salto do elétron do subnível 2s para o 2p é uma “promoção” do elétron. Desse modo, o carbono fica em seu estado excitado ou ativado, com quatro orbitais hibridizados, disponíveis para realizar as ligações covalentes:
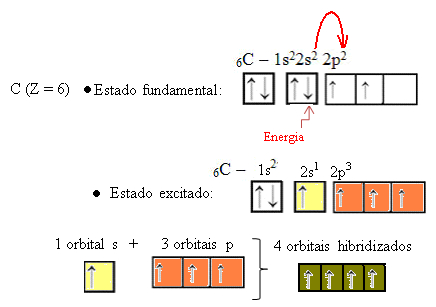
Veja que os orbitais híbridos formados são equivalentes entre si, porém diferentes dos orbitais puros originais.
Desse modo, ocorre a ligação entre o orbital s de cada um dos quatro átomos de hidrogênio com esses quatro orbitais hibridizados do carbono:
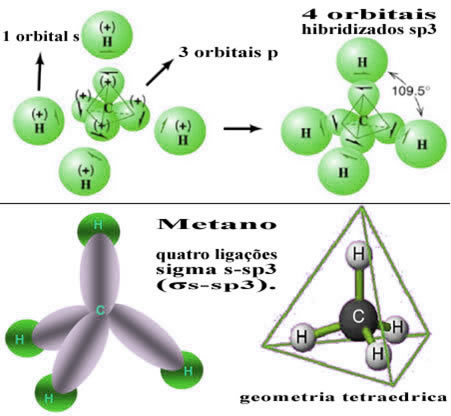
Conforme visto acima, a molécula do metano apresenta uma estrutura de tetraedro regular, com as quatro nuvens eletrônicas em cada vértice e ângulos adjacentes de 109º28’. Visto que a ligação foi realizada entre um orbital s de cada hidrogênio e um orbital hibridizado sp3 para cada ligação, temos então que são quatro ligações sigma s-sp3 (σs-sp3).
Por Jennifer Fogaça
Graduada em Química