As fórmulas das substâncias químicas são representações utilizadas para indicar quais são os elementos químicos que fazem parte da composição da substância e também para representar o tipo de interação entre os átomos participantes.
Por meio da análise da fórmula de uma substância química, podemos determinar a natureza das ligações químicas (iônica, covalente ou metálica) que a formaram, bem como o seu comportamento físico-químico. Algumas das propriedades que estão relacionadas com o comportamento físico-químico de uma substância são:
-
Solubilidade
-
Ponto de fusão
-
Ponto de ebulição
-
Reatividade
Agora conheça os tipos de compostos que formam as substâncias químicas e também as fórmulas que os representam.
Tipos de compostos
Compostos iônicos são todas as substâncias químicas formadas por meio de ligação iônica entre os átomos, ou seja, nesses compostos, existem átomos que perdem e átomos que ganham elétrons. A combinação de elementos químicos que formam esse tipo de composto pode ser:
-
Metal com ametal
-
Metal com hidrogênio
b) Compostos covalentes
Compostos covalentes são todas as substâncias químicas formadas por meio de ligação covalente entre os átomos, ou seja, nesses compostos, existem átomos que compartilham elétrons entre si. A combinação de elementos químicos que formam esse tipo de composto pode ser:
-
Ametal com ametal
-
Ametal com hidrogênio
-
Hidrogênio com hidrogênio
c) Compostos metálicos
Compostos metálicos são todas as substâncias químicas formadas por átomos de um único elemento metálico. Nesses compostos, os átomos apenas compartilham elétrons entre si.
Fórmulas para os compostos iônicos
a) Íon-fórmula
O íon-fórmula indica a quantidade de átomos que formam a unidade iônica do composto, como no caso do cloreto de sódio, cujo íon-fórmula é NaCl. Na fórmula, identificamos a presença de um átomo de sódio e um átomo de cloro.
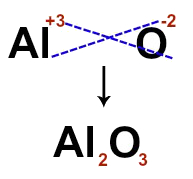
Para construir o íon-fórmula, basta cruzar as cargas de cada um dos íons que formam o composto iônico. Para o cátion Al+3 e o ânion O-2, por exemplo, quando cruzamos as cargas e desprezamos os sinais, temos o seguinte íon-fórmula:
b) Fórmula eletrônica
A fórmula eletrônica é utilizada para representar a perda e o ganho de elétrons dos átomos envolvidos na formação do composto. Em torno da sigla de cada elemento, temos cada um dos elétrons das camadas de valência.
No caso do cloreto de sódio (NaCl), temos no Na apenas um elétron de valência (por ser da família IA) e, no Cl, temos sete elétrons de valência (por ser da família VIIA) representados.
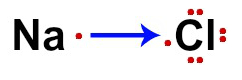
Fórmula eletrônica do NaCl
O ganho do elétron por parte do Cl (ametal) e a perda de um elétron por parte do Na (ametal) são representados por uma seta. De acordo com a teoria do octeto, o Na perde um elétron por ter apenas um, e o Cl ganha um para completar oito elétrons de valência.
Para os compostos covalentes
a) Fórmula molecular
A fórmula molecular é utilizada para representar, de forma simplificada, uma substância covalente. A fórmula molecular da água, que é H2O, por exemplo, possui dois átomos de hidrogênio e um átomo de oxigênio.
Diferentemente do íon-fórmula dos compostos iônicos, a fórmula molecular de uma composto covalente não é construída com tanta simplicidade, já que quantidades diferentes de átomos dos mesmos elementos formam diferentes substâncias, como é o caso da água (H2O) e da água oxigenada (H2O2).
É muito comum, nos exercícios, a fórmula molecular:
-
Ser fornecida pelo próprio exercício;
-
Ser determinada por meio de um cálculo;
-
Ser determinada pela contagem de cada elemento a partir da fórmula estrutural;
-
Ser determinada a partir do nome da substância.
b) Fórmula estrutural
A fórmula estrutural de uma substância covalente é utilizada para representar o número de ligações que cada um dos átomos realiza na molécula. As ligações que são utilizadas na fórmula estrutural são:
-
Ligação simples: representada por um traço (─), indica uma única ligação;
-
Ligação dupla: representada por dois traços (=), indica duas ligações;
-
Ligação tripla: representada por três traços (≡), indica três ligações;
-
Ligação dativa: representada por uma seta (→), indica uma única ligação.
A fórmula estrutural dos compostos covalentes deve ser representada, sempre que possível, de acordo com a geometria molecular da molécula em questão. Veja a representação da fórmula estrutural da amônia, que possui geometria piramidal:
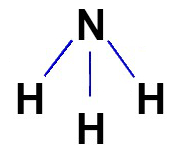
c) Fórmula eletrônica
A fórmula eletrônica de um composto covalente demonstra o compartilhamento dos elétrons entre os átomos que formam a molécula. Em vez dos traços utilizados na fórmula estrutural, temos a utilização de esferas para representar os elétrons compartilhados entre os átomos. Veja:
-
Ligação simples: compartilhamento de dois elétrons (sendo um de cada um dos átomos envolvidos);
-
Ligação dupla: compartilhamento de quatro elétrons (sendo dois de cada um dos átomos envolvidos);
-
Ligação tripla: compartilhamento de seis elétrons (sendo três de cada um dos átomos envolvidos);
-
Ligação dativa: compartilhamento de dois elétrons (sendo os dois de um único átomo entre os envolvidos),
Assim, para a amônia, cuja fórmula estrutural foi representada anteriormente, sua fórmula eletrônica é:
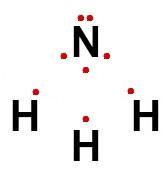
Para os compostos metálicos
Os compostos metálicos, por serem formados exclusivamente por átomos de um único metal, possuem como fórmula química a própria sigla do elemento químico:
-
Substância cobre: Cu
-
Substância ouro: Au
-
Substância ferro: Fe
Por Me. Diogo Lopes Dias