A ligação iônica ocorre entre íons, conforme o próprio nome sugere. Por possuírem cargas opostas, os cátions (elemento com carga positiva) e ânions (elemento com carga negativa) se atraem eletrostaticamente, formando a ligação. No entanto, um sólido iônico é constituído por um aglomerado de cátions e ânions organizados com formas geométricas bem definidas, chamadas de retículos ou reticulados cristalinos.
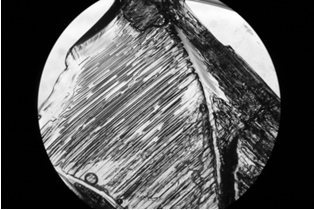
Por exemplo, o sal (cloreto de sódio) é formado pela transferência definitiva de um elétron do sódio para o cloro, originando o cátion sódio (Na+) e o ânion cloreto (Cl-). Na prática, essa reação envolve não só dois átomos, mas um número enorme e indeterminando de átomos que formam um retículo cristalino de forma cúbica, como mostrado abaixo:
.jpg)
Se olharmos os cristais de sal com um microscópio eletrônico de varredura, veremos que são realmente cúbicos por causa da sua estrutura interna.
Visto que todo composto iônico é então formado por um número indeterminado e muito grande de íons, como podemos representar um composto iônico?
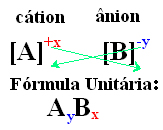
A fórmula utilizada geralmente é a fórmula unitária, que é aquela que representa a proporção expressa pelos menores números possíveis de cátions e ânions que compõem o retículo cristalino, de modo que a carga total do composto seja neutralizada. Para que isso ocorra é necessário que o número de elétrons cedidos por um átomo seja igual ao número de elétrons recebidos pelo outro átomo.
Alguns aspectos sobre a fórmula unitária dos compostos iônicos são importantes, veja alguns:
- Escreve-se sempre primeiro o cátion e depois o ânion;
- Visto que todo composto iônico é eletricamente neutro, as cargas individuais dos íons não precisam ser escritas;
- Os números em subscrito que aparecem do lado direito de cada íon indica a proporção entre os átomos do cátion e os do ânion. Esses números são chamados de índices e o número 1 não é escrito.
Por exemplo, no caso do cloreto de sódio, temos que sua fórmula unitária é NaCl, pois temos exatamente 1 cátion sódio para cada ânion cloreto.
Veja outro exemplo, o Al3+ possui três cargas positivas, enquanto que o F- possui apenas uma negativa, assim são necessários três ânions fluoreto para neutralizar o composto. Com isso, concluímos que sua fórmula unitária é AlF3.
Uma forma simples de chegar à fórmula unitária do composto iônico é trocar as suas cargas pelos seus índices, como mostrado de forma genérica abaixo:
Exemplos:
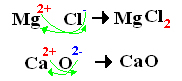
Outra fórmula usada para representar as substâncias iônicas é a fórmula de Lewis ou fórmula eletrônica, que representa os elétrons da camada de valência dos íons “bolinhas” ao redor do símbolo do elemento. No caso do sal, temos:
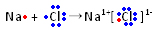
Por Jennifer Fogaça
Graduada em Química

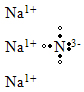 representa uma substância:
representa uma substância: