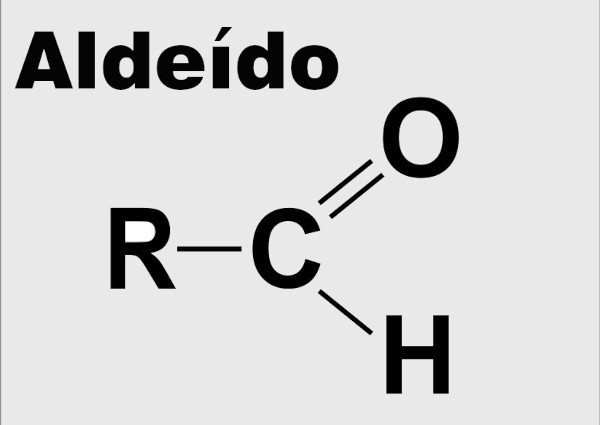
O aldeído é uma função oxigenada da Química orgânica em que há a presença de uma carbonila ligada a um átomo de hidrogênio e a um outro grupamento, o qual pode ser tanto uma cadeia carbônica quanto outro átomo de hidrogênio. Os aldeídos são nomeados oficialmente pela adição do sufixo -al. São obtidos por redução de álcoois, via ozonólise de alcenos, ou por redução de derivados de ácidos carboxílicos.
Os aldeídos possuem ponto de ebulição parelho com cetonas e ésteres, por conta do caráter polar da carbonila. Esse caráter polar também confere uma boa solubilidade em água em aldeídos com até quatro carbonos. O formaldeído é o principal aldeído, usado, entre muitas coisas, como conservante. Contudo, aldeídos também podem ser usados na fabricação de perfumes e flavorizantes.
Leia também: Quais são as funções oxigenadas?
Tópicos deste artigo
- 1 - Resumo sobre aldeídos
- 2 - Videoaula sobre aldeídos
- 3 - O que é um aldeído?
- 4 - Nomenclatura dos aldeídos
- 5 - Propriedades dos aldeídos
- 6 - Para que servem os aldeídos?
- 7 - Quais são os principais aldeídos?
- 8 - Obtenção dos aldeídos
- 9 - Aldeídos x cetonas
- 10 - Exercícios resolvidos sobre aldeídos
Resumo sobre aldeídos
-
Aldeído é uma função orgânica em que um grupo carbonila está ligado a um átomo de hidrogênio e a um grupo R, o qual pode ser outro átomo de hidrogênio ou uma cadeia carbônica.
-
Todo aldeído, segundo a Iupac, possui sufixo -al.
-
Os aldeídos, por conta da carbonila, possuem bom caráter polar até quatro carbonos, sendo, até esse limite, solúveis em água.
-
Possuem ponto de ebulição análogo aos dos ésteres e cetonas de mesmo volume molecular.
Não pare agora... Tem mais depois da publicidade ;) -
Podem ser utilizados para fabricação de perfumes e flavorizantes.
-
O formaldeído é o principal aldeído que existe, sendo muito utilizado para síntese de plásticos, resinas e como conservante de cadáveres.
-
Os aldeídos podem ser sintetizados via reações de oxidação de álcoois primários, ozonólise de alcenos e redução de derivados de ácidos carboxílicos.
Videoaula sobre aldeídos
O que é um aldeído?
Segundo a União Internacional de Química Pura e Aplicada (Iupac), aldeídos são compostos em que um grupo carbonila (C=O) está ligado a um átomo de hidrogênio e a um grupamento R, o qual pode ser uma cadeia carbônica ou outro átomo de hidrogênio.
Nomenclatura dos aldeídos
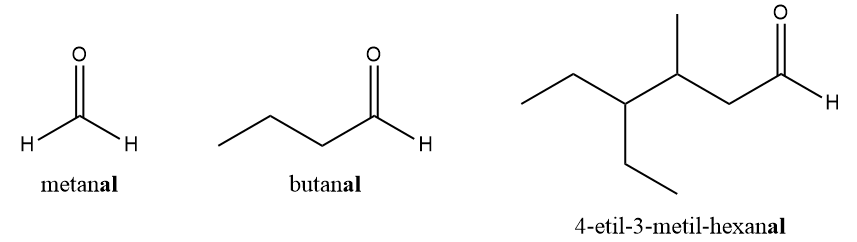
A Iupac estabelece que os aldeídos devem possuir o sufixo -al. Obrigatoriamente, o carbono da carbonila deve ser o carbono de número 1 da cadeia principal, já que ele também identifica a função orgânica. Dessa forma, no nome oficial dos aldeídos, não há necessidade de se indicar a posição da carbonila, pois isso seria redundante.
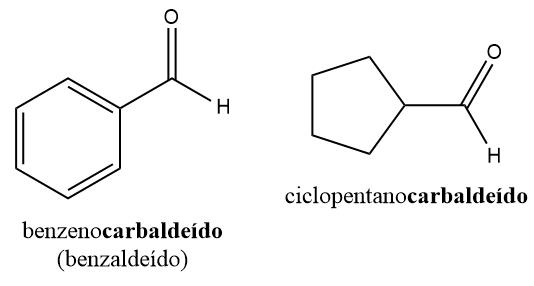
Aldeídos em que o grupo –CHO está ligado a um anel são nomeados pela adição do sufixo carbaldeído.
Propriedades dos aldeídos
O grupo carbonila é um grupamento de caráter polar. Por isso, quando comparados aos hidrocarbonetos de volume molecular análogo (os quais são apolares ou muito pouco polares), percebe-se que os aldeídos possuem maior temperatura de ebulição. Isso é consequência direta da formação de interações intermoleculares do tipo dipolo-dipolo, algo que não é significativamente possível em hidrocarbonetos.
Contudo, quando comparados aos álcoois, os aldeídos de tamanho análogo possuem menor temperatura de ebulição. Isso porque os álcoois são capazes de fazer ligações de hidrogênio entre suas moléculas, algo que os aldeídos não conseguem.
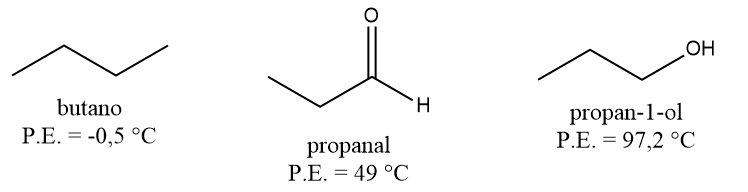
Quando comparados a outros compostos carbonilados, os aldeídos possuem um ponto de ebulição próximo ao dos ésteres e cetonas de volume molecular semelhante. Contudo, eles apresentam menor ponto de ebulição quando comparados aos ácidos carboxílicos e às amidas de volume molecular semelhante.
Quanto à solubilidade, sabe-se que o oxigênio da carbonila do aldeído é capaz de realizar ligações de hidrogênio com as moléculas de água e, por isso, os aldeídos com até quatro carbonos são muito solúveis em água. A partir de cinco carbonos, o caráter apolar da cadeia carbônica começa a ser mais preponderante, diminuindo a solubilidade desses compostos em água.
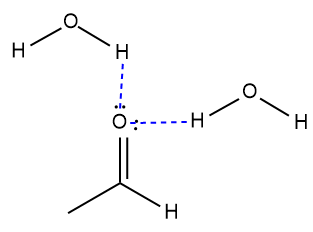
Para que servem os aldeídos?
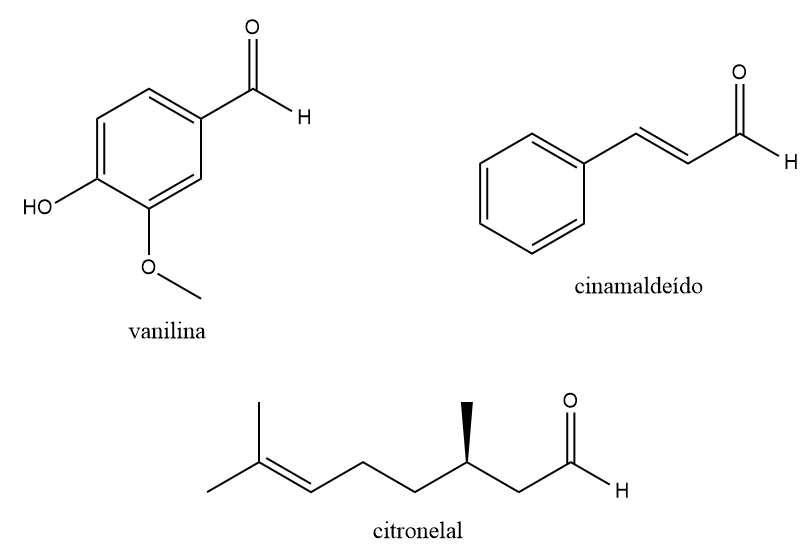
Alguns aldeídos que podem ser obtidos de fontes naturais possuem um odor bem agradável e pungente. Por isso, podem ser explorados na fabricação de perfumes e cosméticos, como é o caso do citronelal (aroma de eucalipto limão), a vanilina (aroma de baunilha) e o cinamaldeído (aroma de canela).
Os aldeídos ainda podem ser utilizados como flavorizantes e intermediários para a fabricação de plásticos, resinas e medicamentos.
De odor intenso, mas não muito agradável, o metanal (formaldeído), comercializado em uma solução aquosa com concentração de 37% sob o nome de formol, é usado em produtos de higiene e cosméticos, nos quais atua como conservante (evitando, assim, a contaminação do produto).
Desde o século XIX, o formol é utilizado como conservante de cadáveres e outras peças anatômicas, algo que ainda se mantém por conta de seu baixo custo, rápida penetração tecidual e conservação por muitos anos.
Apesar dos riscos (o formol é tóxico e cancerígeno, além de possuir vapores muito irritantes), um estudo realizado pela Revista de Medicina da USP, publicado em 2016, apontou que cerca de 83% das faculdades de medicina do Brasil ainda utilizam o formol para conservação de peças anatômicas.

O formol também foi muito utilizado como produto alisante no começo dos anos 2000. Entretanto, a Agência Nacional de Vigilância Sanitária proibiu a sua utilização para tal fim. Segundo ela, a adição de formol em produtos alisantes configura infração sanitária e é crime hediondo, de acordo com o artigo 273 do Código Penal. Mesmo assim, em 2019, a Anvisa informou que, em uma pesquisa, cerca de 35% dos fiscais questionados ainda constataram o uso irregular de tal substância em alisantes.
Apesar de tudo, o metanal tem grande importância para a indústria, pois por meio dele são produzidos diversos materiais poliméricos. A baquelite, por exemplo, é produzida pela reação do metanal com o fenol. Adesivos podem ser produzidos pela reação entre esse aldeído e a uréia ou a melamina. Por fim, o metanal ainda pode ser usado como fungicida, germicida e inseticida para plantas e vegetais.
Leia também: Éter — fórmula geral, características e aplicações
Quais são os principais aldeídos?
Sem dúvida alguma e dada sua grande importância industrial, o principal aldeído é o formaldeído (metanal), cuja produção anual gira em torno de 21 milhões de toneladas.
Em menor escala, alguns outros aldeídos são importantes por conta de seu aroma. Alguns já foram citados neste artigo, como a vanilina, o cinamaldeídeo, o citronelal e o benzaldeído (odor de amêndoas).
O etanal (acetaldeído) também é muito conhecido, pois ele é obtido da quebra do etanol dentro do organismo humano. Assim, sua concentração se eleva bastante depois de episódios de grande ingestão de bebidas alcoólicas. O etanal, por conseguinte, é o responsável pelos efeitos da ressaca, que causa fortes dores de cabeça, sensibilidade à luz e ao som, enjoo, vômito, dores no corpo, boca seca, perda de apetite, dor no estômago, além de amnésia (o chamado blecaute alcoólico).
Obtenção dos aldeídos
-
Oxidação de álcoois primários
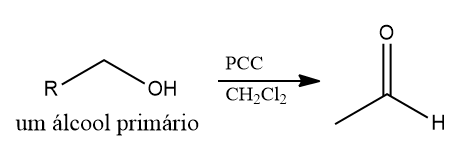
Três formas de oxidação de álcoois primários geram aldeídos: a oxidação de Swern, a oxidação com clorocromato de piridínio (PCC), e a oxidação com ácido hipocloroso.
Na oxidação de Swern, é utilizado dimetilsulfóxido (DMSO), cloreto de oxalila (COCl)2 e trietilamina, em uma temperatura negativa, na faixa dos -60 °C.
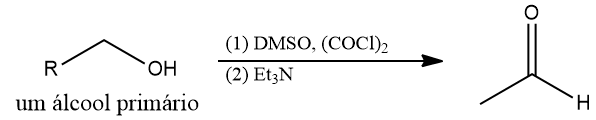
Na oxidação com PCC, o solvente deve ser anidro, como CH2Cl2. A presença de água pode oxidar o aldeído em ácido carboxílico.
Pensando-se nos problemas tóxicos do cromo, o ácido hipocloroso (HOCl) também pode ser utilizado como oxidante de álcoois primários. Sendo instável, o HOCl é formado em reação pela neutralização de ácido acético com hipoclorito de sódio.
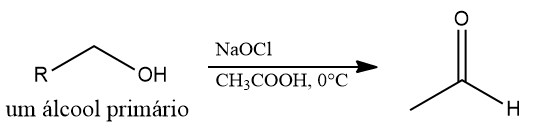
-
Ozonólise de alcenos
Aldeídos podem ser formados por meio da ozonólise da dupla ligação de alcenos. Outro subproduto formado são as cetonas. Para que seja formado um aldeído, o carbono da ligação dupla não pode estar ramificado. Do contrário, dará origem a uma cetona.
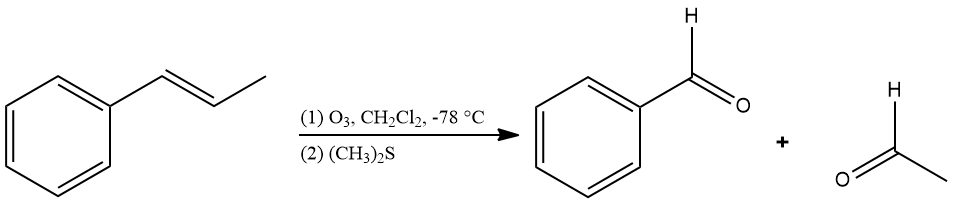
-
Redução de ésteres, cloretos de acila e nitrilas
Teoricamente, poderia ser pensado que a redução de ácidos carboxílicos com bons redutores, como LiAlH4, resultaria em aldeídos. No entanto, isso não ocorre, e o ácido carboxílico é reduzido diretamente ao álcool primário, muito pelo fato de os aldeídos se reduzirem facilmente e porque o LiAlH4 é um redutor muito forte.
Dessa forma, obtém-se aldeído via redução utilizando-se de um redutor mais moderado, como é o caso do DIBAL-H (hidreto de di-isobutilalumínio) e do hidreto de triterc-butoxialumínio e lítio, LiAlH(O-t-Bu)3.
Cloretos de acila, ésteres e nitrilas são derivados de ácido carboxílico bem mais facilmente reduzidos. Por isso, é interessante que, para síntese do aldeído via redução, os ácidos carboxílicos sejam convertidos a uma dessas três funções. O esquema a seguir demonstra essas reduções.
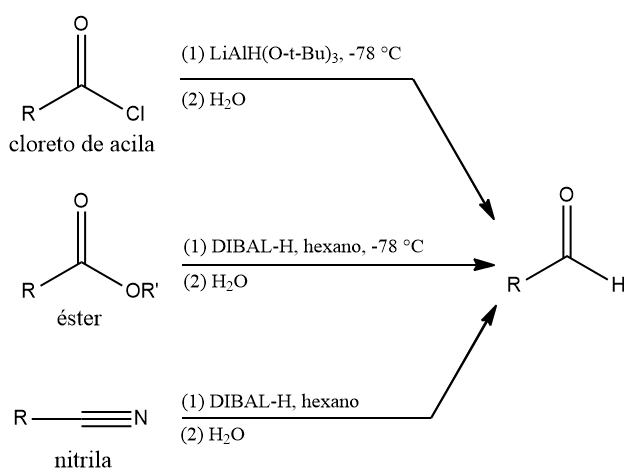
Aldeídos x cetonas
Embora muito parecidos visualmentes, os aldeídos e cetonas possuem uma diferença marcante. Enquanto na carbonila do aldeído uma das ligações é feita com hidrogênio obrigatoriamente, na cetona, a carbonila fica entre duas cadeias carbônicas.
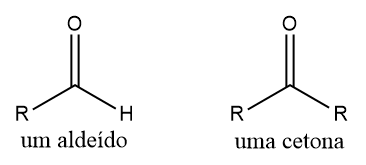
Contudo, essas duas funções compartilham algumas semelhanças. Por exemplo, aldeídos e cetonas de volume molecular semelhante possuem pontos de ebulição próximos. Assim como os aldeídos, cetonas de até quatro carbonos são bem solúveis em água. As cetonas também são usadas na fabricação de perfumes e flavorizantes.
Enquanto a oxidação de álcoois primários gera aldeídos, a oxidação de álcoois secundários gera cetonas. Na ozonólise, a cetona é um dos produtos possíveis, junto do aldeído.
Exercícios resolvidos sobre aldeídos
Questão 1
(FMABC-SP/2022) Analise as fórmulas estruturais dos óleos essenciais geranial e geraniol, que apresentam odor de limão e odor de rosas, respectivamente.
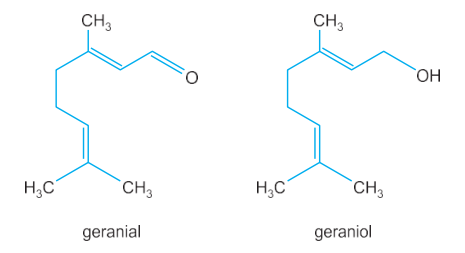
O exame dessas estruturas permite concluir que o geranial
(A) pode ser obtido por oxidação do geraniol.
(B) é isômero de cadeia do geraniol.
(C) tem mais insaturações entre átomos de carbono que o geraniol.
(D) é um aldeído e o geraniol é um fenol.
(E) apresenta isômeros ópticos.
Resposta: Letra A
O geraniol possui um grupo álcool primário na sua extremidade superior. Esse grupo, ao ser oxidado, pode dar origem ao geranial, que possui um grupo aldeído na extremidade superior.
Questão 2
(Uerj-2020/2) A hemoglobina glicada é um parâmetro de análise sanguínea que expressa a quantidade de glicose ligada às moléculas de hemoglobina. Essa ligação ocorre por meio da reação representada a seguir:
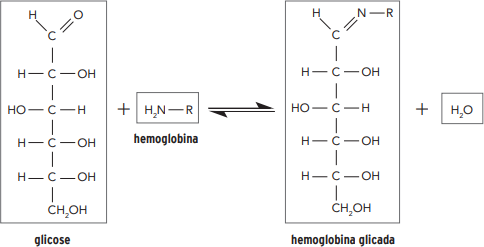
O grupamento funcional da molécula de glicose que reage com a hemoglobina corresponde à função orgânica denominada:
(A) amina
(B) álcool
(C) cetona
(D) aldeído
Resposta: Letra D
Percebe-se que a conversão da glicose em hemoglobina glicada ocorre pela alteração da carbonila na extremidade de sua cadeia, dando origem a um novo grupamento. Essa alteração comprova que a hemoglobina reagiu com a parte que corresponde à função aldeído da glicose.
Fontes
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, v. 66, n. 5, p. 1077-1184, 1994.
SOLOMONS, T. W. G.; FRYHLE, C. B.; SNYDER, S. A. Química Orgânica: volumes 1 e 2. 12. ed. Rio de Janeiro: LTC, 2018.
BRUICE, P. Y. Organic Chemistry. 8. ed. Upper Saddle River, Nova Jersey: Pearson Education Inc., 2015.
INSTITUTO NACIONAL DO CÂNCER – INCA. Formol. 24 mai. 2022. Disponível em: . Acesso em 30 out. 2023.
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA – ANVISA. Formol não pode ser utilizado em alisantes de cabelo. 01 jul. 2022. Disponível em: . Acesso em 30 out. 2023.
DA SILVA, G. R.; CORTEZ, P. O. B. C.; LOPES, I. S. L. L.; TEIXEIRA, B. A. C. B.; LEAL, N. M. S. Métodos de conservação de cadáveres humanos utilizados nas faculdades de medicina do Brasil. Revista de Medicina. v. 95, n. 4, p. 156-161, 2016.
MARCH, J.; BROWN, W. H. Uses of aldehyde. Britannica. Disponível em: . Acesso em 30 out. 2023.
INTERNATIONAL AGENCY FOR REASEARCH ON CANCER – IARC. Formaldehyde, 2-Butoxyethanol and 1-tert-Butoxypropan-2-ol. In: IARC Monographs on Evaluation of Carcinogenic Risk to Humans. V. 88. 2006.
REDE D’OR. Ressaca. Disponível em: . Acesso em 30 out. 2023.