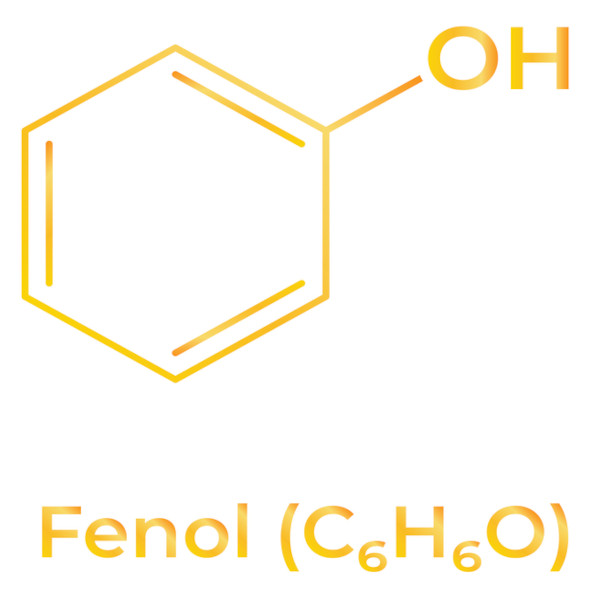
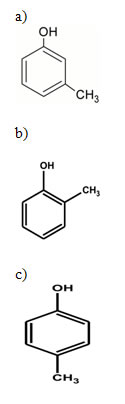
O fenol é uma função orgânica oxigenada que ocorre quando uma ou mais hidroxilas (−OH) se ligam diretamente a um anel aromático. Desses grupos, o mais conhecido é o fenol mais simples, que ocorre quando a hidroxila está ligada a um anel benzênico e, por recomendações da Iupac, também pode ser chamado de fenol.
O fenol costuma apresentar baixa acidez (sendo mais ácidos que os álcoois, também hidroxilados), além de ser orto-para dirigentes em reações de substituição eletrofílica aromática. A principal forma de obtenção é por meio da oxidação do cumeno (isopropilbenzeno). Boa parte do fenol produzido é utilizado na produção da resina fenólica.
Leia também: Álcoois — função orgânica oxigenada que tem uma hidroxila ligada a um ou mais carbonos saturados
Tópicos deste artigo
- 1 - Resumo sobre fenol
- 2 - Videoaula sobre o fenol
- 3 - O que é fenol?
- 4 - Propriedades do fenol
- 5 - Características do fenol
- 6 - Nomenclatura do fenol
- 7 - Obtenção do fenol
- 8 - Para que serve o fenol?
- 9 - Principais fenóis
- 10 - Riscos do fenol à saúde
- 11 - Exercícios resolvidos sobre fenol
Resumo sobre fenol
-
Fenol é um grupo orgânico caracterizado pela presença de um ou mais grupos hidroxilas ligados diretamente a um anel aromático.
-
Desses grupos, o mais famoso é o que apresenta uma hidroxila ligada ao anel benzênico, que também recebe o nome de fenol.
-
Em comparação aos álcoois, os fenóis são mais ácidos.
-
A hidroxila do fenol direciona substituições nas posições orto e para em reações de substituição eletrofílica aromática.
Não pare agora... Tem mais depois da publicidade ;) -
Boa parte do fenol é produzida via oxidação do cumeno (processo Hock).
-
Os principais fenóis são cresol, xilenol, propofol e BHT (hidroxitolueno butilado).
-
O fenol tem muitas aplicações, sendo a principal na produção de uma resina fenólica.
-
O fenol é um composto tóxico em altas concentrações e pode causar envenenamento.
Videoaula sobre o fenol
O que é fenol?
Segundo a União Internacional de Química Pura e Aplicada (Iupac), fenóis são compostos que têm um ou mais grupos hidroxila (−OH) ligados a um anel benzênico ou outro anel arênico (aromático). O fenol mais conhecido (e simples) é aquele em que o anel benzênico está ligado a uma única hidroxila, e, segundo a própria Iupac, tal estrutura pode também ser chamada de fenol, sendo um caso em que o composto recebe o mesmo nome da classe a que pertence.
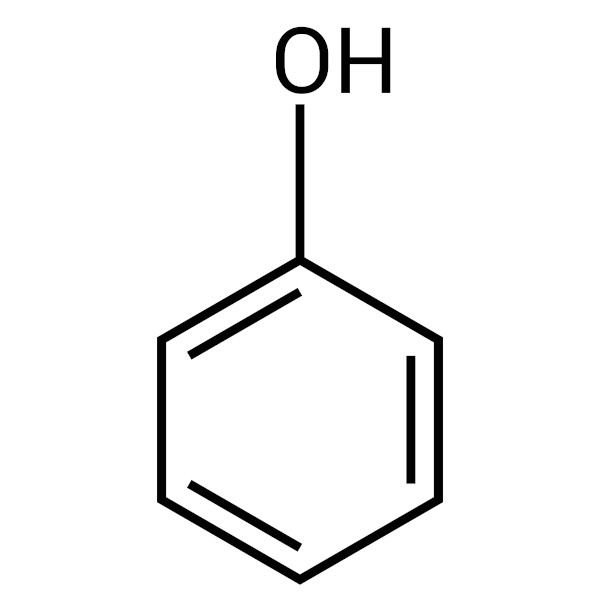
Propriedades do fenol
As propriedades aqui listadas são referentes ao fenol (substância, não classe).
-
Fórmula molecular: C6H6O
-
Massa molecular: 94,111 u.m.a
-
Ponto de solidificação/fusão: 40,91 °C
-
Ponto de ebulição: 181,8 °C
-
Densidade: 1,0545 g.cm−3
Características do fenol
O fenol (C6H6O) tem um baixo ponto de fusão, sendo que sua forma sólida se apresenta por meio de cristais incolores. Apresenta odor característico e levemente pungente. Na forma líquida, é incolor, e, em temperaturas inferiores a 68,4 °C, a sua miscibilidade com água é limitada, sendo completamente miscível em temperaturas superiores.
Além disso, o fenol dissolve-se prontamente em solventes orgânicos, como hidrocarbonetos aromáticos, álcoois, cetonas, éteres, ácidos orgânicos, derivados halogenados, entre outros, porém é um pouco menos solúvel em hidrocarbonetos alifáticos (não aromáticos).
Quando misturado à água, o ponto de fusão do fenol cai substancialmente, e, além disso, forma-se uma mistura azeotrópica (o ponto de ebulição da solução é constante, comportando-se como uma substância pura).
A presença da hidroxila faz crer que o fenol possa estar dentro da classe dos álcoois, no entanto, há algumas diferenças. A principal delas diz respeito à acidez, em que o fenol apresenta uma maior acidez que os álcoois, pois o anel aromático permite a estabilização do íon fenóxido por ressonância, aumentando-se a concentração de íons H+ em solução.
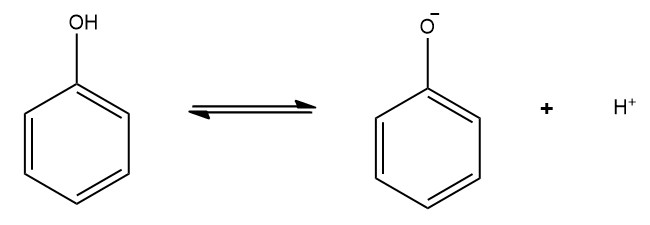
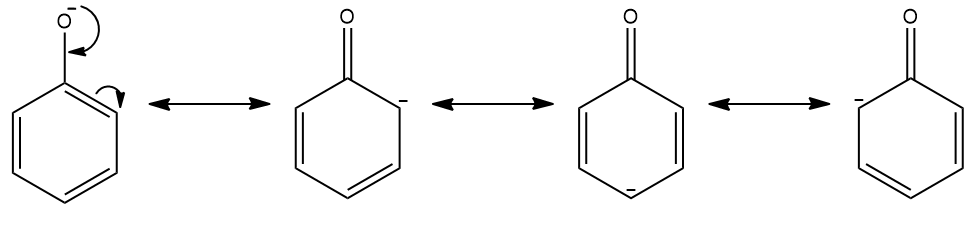
Dessa forma, o fenol pode formar sais por meio da reação com compostos alcalinos, os fenolatos. Contudo, é considerado um ácido fraco (pKa = 9,94 em água). Assim como outros aromáticos, o fenol sofre reações de substituição eletrofílica, porém o grupo hidroxila é um grupo orto-para dirigente, ou seja, favorece que a substituição ocorra nas posições 2 e 4 em relação a ele.
Nomenclatura do fenol
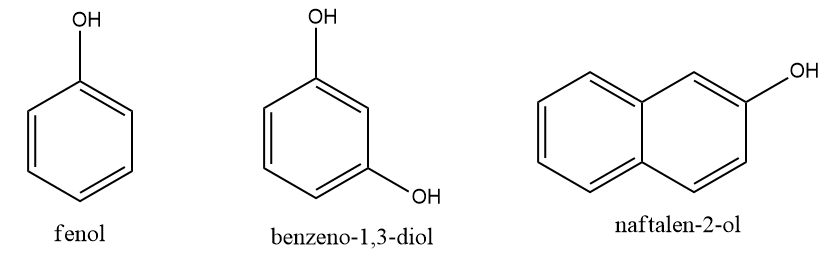
A questão da nomenclatura para o fenol tem uma particularidade. A Iupac considera o nome “fenol”, para se referir ao anel benzênico com uma única hidroxila, uma nomenclatura trivial, porém permite que assim o seja designado oficialmente. No entanto, para casos diferentes desses, em que há dois ou mais grupos hidroxilas ligados ao anel benzênico, ou que a hidroxila esteja ligada a outro anel aromático, considera-se o tipo de aromático que formou o fenol e pode-se utilizar o sufixo −ol, como nos álcoois.
Obtenção do fenol
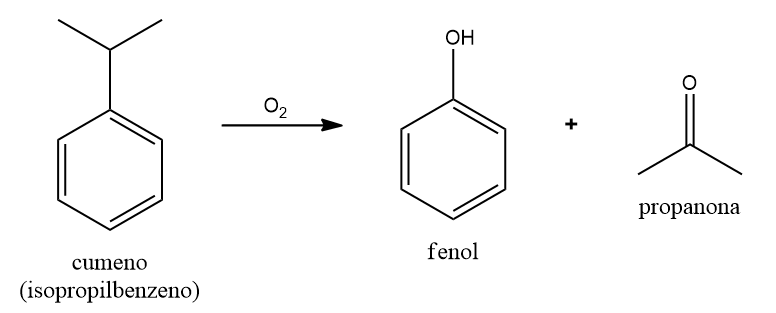
Atualmente, a melhor e mais difundida forma de obtenção do fenol (C6H6O), inclusive em larga escala, é por meio da oxidação do cumeno (isopropilbenzeno), conhecido como processo Hock, desenvolvido em 1952 e que tem como subproduto um outro importante composto orgânico, a propanona (acetona).
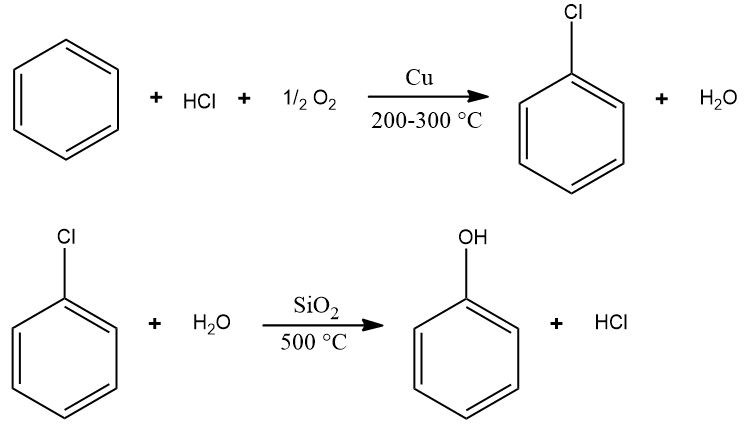
Contudo, outras formas comerciais de obtenção também são de grande interesse. Uma delas é o processo Raschig, em que o benzeno é convertido a clorobenzeno em um reator catalisado por cobre (ou ferro), em uma temperatura que deve variar entre 200-300 °C na presença de ar. O clorobenzeno é então hidrolisado pela água ao passar por um catalisador de SiO2 aquecido em temperatura de 500 °C, produzindo assim fenol.
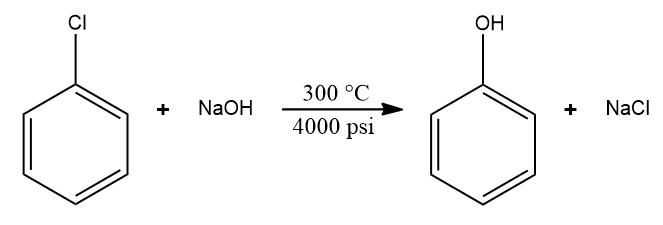
Já o processo Dow, desenvolvido em 1920, faz a reação direta e vigorosa de clorobenzeno e solução de hidróxido de sódio em 300 °C e 4000 psi de pressão.
O fenol também pode ser produzido de sulfonatos de metais alcalinos, na presença de um pouco de água. A ideia é fazer a conversão do benzeno em ácido benzenossulfônico, o qual é convertido em um sal benzenossulfonato de metal alcalino (como sódio), que será transformado em fenol. Esse método também pode funcionar se o ácido benzenossulfônico for posto junto a uma quantidade de hidróxido de sódio sólido e aquecer o sistema até a fusão completa, formando, no fim, o fenol.
Para que serve o fenol?
O uso do fenol se iniciou em 1865, como um desinfetante, por meio do cirurgião britânico Joseph Lister (na Universidade de Glasgow, Escócia), que utilizava o composto para esterilização. Entretanto, seus usos em produtos farmacêuticos têm sido restringidos por conta de sua toxicidade. Mesmo assim, hoje se utiliza muito a técnica de peeling com fenol, que consiste num tratamento muito eficaz para o combate às rugas e flacidez da pele. Contudo, tal técnica exige muitos cuidados, dada a sua agressividade.
Um dos grandes usos do fenol é na produção do bisfenol-A (BPA). Tal composto é de grande importância para a indústria de plásticos, sendo aplicado em policarbonatos e resinas epóxi. O fenol também é usado em aditivos para óleos lubrificantes, na produção do nylon, herbicidas, fungicidas, entre outros diversos usos.
Seu principal uso está na produção de resinas fenólicas, que são polímeros termorrígidos, as primeiras produzidas por seres humanos e sintetizadas por meio da reação entre o fenol e um aldeído (em geral, o formaldeído). Por conta disso, as resinas fenólicas também podem ser chamadas de resinas fenol-formaldeído. Destacam-se pela boa resistência e estabilidade térmica, alta resistência e estabilidade mecânica, além de poderem agir como excelentes isolantes térmicos e elétricos.
São usadas em diversos setores, seja na forma líquida, seja na forma sólida, como na produção de produtos moldados (como em bolas de bilhar), no setor de peças automobilísticas (como em pastilhas de freio e discos de embreagem), para revestimentos, tintas, vernizes e adesivos. Em um dos usos de adesivo, a resina fenólica é empregada na madeira compensada e em painéis de madeira aglomerados.
Principais fenóis
-
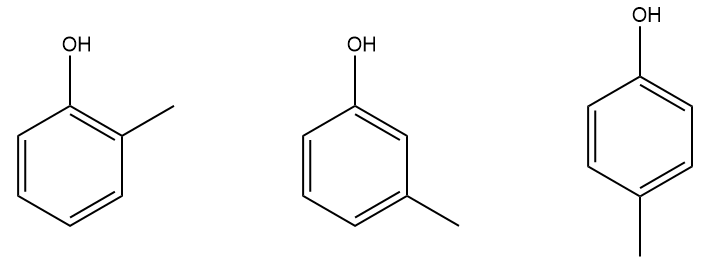
Cresóis: são do tipo metilfenol (orto, meta ou para), usados como desinfetantes, solventes, desodorizantes ou precursores de outras moléculas orgânicas.
-
Xilenóis: são do tipo dimetilfenol (existem seis isômeros de posição), podendo ser usados na manufatura de antioxidantes e pesticidas.
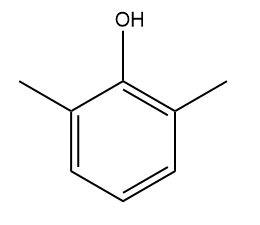
-
Propofóis: do tipo diisopropilfenol, são usados como agentes anestésicos intravenosos de curta duração, sendo adequados para indução e manutenção de anestesia geral em processos cirúrgicos. A ação anestésica se inicia em cerca de 30 segundos.
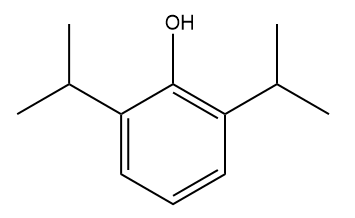
-
BHT (hidroxitolueno butilado): usado como antioxidante pela indústria alimentícia, farmacêutica, cosmética e em derivados do petróleo. Pode ser comercializado como suplemento alimentar também.
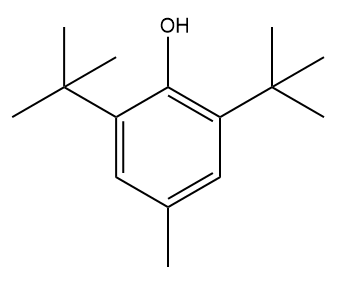
Riscos do fenol à saúde
O fenol é considerado um composto tóxico quando em altas concentrações. Pode ser absorvido pela pele, por inalação ou via oral, sendo a via epidermial a mais frequente, pela qual o fenol é absorvido mais rapidamente, causando queimaduras na área afetada e/ou aumento da sensibilidade.
Um envenenamento mais contundente pelo fenol pode causar uma rápida paralisia do sistema nervoso central, fazendo decair nossa temperatura corporal e havendo perda de consciência. Se houver penetração de fenol em nossos tecidos, pode desencadear em uma gangrena fenólica por meio de danificação de vasos sanguíneos.
Não sendo um envenenamento fatal, o fenol pode, ainda, causar danos em diversos órgãos, como rins, fígado, pulmões e coração. Além disso, distúrbios neuropsiquiátricos já foram relatados após sobrevivência de envenenamento agudo por fenol.
Exercícios resolvidos sobre fenol
Questão 1
(USS) O ácido pícrico, cuja molécula é representada a seguir, é utilizado no preparo de pomadas para o tratamento de queimaduras.
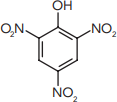
Esse composto pertence à função orgânica oxigenada nomeada como:
-
éter
Não pare agora... Tem mais depois da publicidade ;) -
fenol
-
álcool
-
amida
Resolução:
Alternativa B
A função oxigenada do ácido pícrico é consequência da hidroxila ligada ao anel benzênico. Nesse caso, trata-se de um fenol.
Questão 2
(Imepac) Os fenóis são compostos orgânicos oxigenados que apresentam na sua constituição o grupo hidroxila ligado ao anel aromático. A mononitração dos fenóis é de grande aplicabilidade industrial nos processos de produção de tintas e corantes.
Os produtos obtidos da mononitração dos fenóis, além da água, são uma mistura isomérica de nitrofenol
-
orto e meta.
-
orto e para.
-
meta e para.
Não pare agora... Tem mais depois da publicidade ;) -
orto, meta e para.
Resolução:
Alternativa B
A hidroxila do fenol ativa as posições orto e para em reações de substituição eletrofílica aromática. Sendo assim, ao se fazer a nitração de um fenol, os nitrofenóis isômeros de posição formados serão do tipo orto e para.
Fontes
BRUICE, P. Y. Organic Chemistry. 8. ed. Upper Saddle River, Nova Jersey: Pearson Education Inc., 2015.
CHEMEUROPE. Xylenol. ChemEurope, c1997-2024. Disponível em: https://www.chemeurope.com/en/encyclopedia/Xylenol.html.
CASTRO, L. S. Contribuições para o conhecimento dos efeitos do BHT e outros antioxidantes no fígado. 2017. Dissertação (Mestrado em Ciência de Alimentos) – Centro de Ciências Agrárias, Universidade Estadual de Maringá, Maringá, Paraná, 2017.
ECYCLE. Entenda o que são resinas fenólicas. Portal eCycle, [s.d.]. Disponível em: https://www.ecycle.com.br/entenda-o-que-sao-as-resinas-fenolicas/.
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.
HEPWORTH, J. D.; WARING, D. R.; WARING, M. J. Aromatic Chemistry. In: Tutorial Chemistry Texts. v. 13. Cambridge: Royal Society of Chemistry, 2002.
HOSPITAL SÍRIO LIBANÊS. Propofol. Guia Farmacêutico, 24 abr. 2023. Disponível em: https://guiafarmaceutico.hsl.org.br/propofol.
IBEH, C. C. Phenol-Formaldehyde Resins. In: Handbook of Thermoset Plastics. Ed. 2. Cap. 2. p. 23-71. Norwich, Nova Iorque: William Andrew Inc., 1999.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, 1994.
PORTAL DRAUZIO VARELLA. Peeling de fenol é usado contra rugas e flacidez, mas pode ser perigoso quando feito de forma inadequada. Portal Drauzio Varella, 30 dez. 2022. Disponível em: https://drauziovarella.uol.com.br/dermatologia/peeling-de-fenol-e-usado-contra-rugas-mas-pode-ser-perigoso/.
PUBCHEM. Cresol. PubChem, [s.d.]. Disponível em: https://pubchem.ncbi.nlm.nih.gov/compound/Methylphenol.
RAPPOPORT, Z. (ed.) The chemistry of phenols – part 1. In: Patai Series: The Chemistry of Functional Groups. Londres: John Wiley & Sons Ltd., 2003.
SOLOMONS, T. W. G.; FRYHLE, C. B.; SNYDER, S. A. Química Orgânica: volumes 1 e 2. 12. ed. Rio de Janeiro: LTC, 2018.