PUBLICIDADE
Calorimetria é a área da Física responsável pelo estudo das trocas de energia térmica em forma de calor que ocorrem entre dois ou mais corpos e suas vizinhanças. Por meio da Calorimetria, é possível saber qual é a temperatura de equilíbrio de um sistema de corpos e qual é a quantidade de energia térmica necessária para que se observem variações de temperatura ou mudanças de estado físico no sistema.
Tópicos deste artigo
- 1 - O que é calor?
- 2 - Mapa Mental: Calor
- 3 - Fórmulas para calcular o calor
- 4 - Curva de aquecimento
- 5 - Trocas de calor
- 6 - Exercícios resolvidos de Calorimetria
O que é calor?
Calor é energia térmica em trânsito. Quando dois corpos estão em contato térmico, ocorre transferência de calor entre eles até que se estabeleça o equilíbrio térmico. O equilíbrio térmico, por sua vez, é a situação em que os dois corpos atingem a mesma temperatura. Além disso, o calor sempre flui do corpo de maior temperatura para o corpo de menor temperatura.
Entendemos por contato térmico qualquer meio existente entre dois ou mais corpos que permita a transferência de calor entre eles por um dos seguintes processos: contato, convecção e indução. Quaisquer transferências de calor entre dois corpos ocorrem segundo um ou mais desses processos.
Calor é uma forma de energia em trânsito que flui sempre do corpo mais quente para o corpo mais frio.
Veja também: Água gelada ajuda a emagrecer?
A unidade de calor no Sistema Internacional de Unidades é o Joule (J), no entanto, o uso da unidade caloria (cal) é bastante comum em todo o mundo. Uma caloria é o equivalente à quantidade de energia térmica necessária para se elevar a temperatura de 1,0 g de água pura, inicialmente a 14,5ºC, para 15,5ºC e vale 4,186 J.
Mapa Mental: Calor
.jpeg)
*Para baixar o mapa mental em PDF, clique aqui!
Fórmulas para calcular o calor
Calor sensível
Quando um corpo tem a sua temperatura alterada, podendo também sofrer mudanças em suas dimensões, dizemos que ele recebeu somente calor sensível. Portanto, o calor do tipo sensível é capaz de variar a temperatura de um corpo, alterando ou não as suas dimensões, por meio do processo de dilatação térmica.
A fórmula utilizada para calcular o calor sensível é esta:
![]()
Legenda:
Q – Quantidade de calor (J ou cal)
m – Massa do corpo (kg ou g)
c – Calor específico (J/kg.K ou cal/gºC)
ΔT – Variação de temperatura (K ou ºC)
Veja também: Temperatura e calor
Calor específico
Uma grandeza importante está presente na equação acima, o calor específico, representado pela letra c. Calor específico é uma unidade que indica a quantidade de calorias necessárias para se elevar em 1,0 ºC uma massa de 1,0 g de determinada substância. Essa unidade é medida com referência na água pura, cujo calor específico é igual a 1,0 cal/gºC.
Confira, na tabela a seguir, o calor específico de algumas substâncias:
|
Substância |
Calor específico (cal/gºC) |
|
Água |
1 |
|
Gelo |
0,5 |
|
Etanol |
0,58 |
|
Ouro |
0,03 |
|
Prata |
0,06 |
Ao analisarmos a unidade que define a grandeza calor específico, percebemos que cada grama de uma substância deve absorver mais ou menos calorias para variar a sua temperatura em 1,0 ºC. Essa propriedade depende diretamente do número de grau de liberdade apresentado pelas moléculas do corpo. Quanto maior for o seu grau de liberdade, isto é, as suas possibilidades de movimentação, tais como translação, vibração e rotação, maior será o seu calor específico. Além disso, para determinarmos o calor específico de uma substância, utiliza-se um instrumento de medida relativamente simples, o calorímetro.
Capacidade térmica
Capacidade térmica é uma grandeza física utilizada para definir a quantidade de calor que um corpo deve receber, ou ceder, para que a sua temperatura varie em 1,0 ºC ou 1,0 K. Diferentemente do calor específico, essa grandeza está relacionada com o corpo como um todo, e não somente com cada grama de sua composição. Por essa razão, dizemos que calor específico é uma propriedade da substância, enquanto a capacidade térmica é uma propriedade do corpo em si.
As duas fórmulas que podem ser utilizadas para calcular a capacidade térmica de um corpo são representadas a seguir:
![]()
Legenda:
C – Capacidade térmica (cal/g ou J/kg)
Quando algum corpo apresenta uma grande capacidade térmica, ele é chamado de reservatório térmico. Todo reservatório térmico precisa absorver ou ceder grandes quantidades de calor para ter a sua temperatura alterada. Um bom exemplo de reservatório térmico para a Terra são os mares, que são compostos majoritariamente por água, uma substância de alto calor específico. Essa característica torna os mares os grandes reguladores da temperatura global.
Calor latente
Calor latente, ou calor de transformação, é a quantidade de calor recebida por um corpo durante uma mudança de estado físico. Se algum corpo constituído apenas por uma única substância sofrer mudanças em seu estado físico, passando do estado sólido para o estado gasoso, por exemplo, ele recebeu calor latente. Durante a mudança de estado físico, todo o calor que um corpo recebe, ou cede, somente altera o seu estado, sem afetar a sua temperatura. Quando a água atinge a temperatura de fervura, por exemplo, sob condições normais de pressão, sua temperatura permanece constante enquanto ela sofre o processo de vaporização.
Para calcularmos a quantidade de calor latente em alguma mudança de estado físico, usamos a seguinte fórmula:
![]()
Legenda:
Q – Quantidade de calor latente (J ou cal)
m – Massa do corpo (kg ou g)
L – Calor latente de fusão (LF), vaporização (LV), etc. (J/kg ou cal/g)
Confira, na tabela a seguir, os valores de calor latente de fusão para algumas substâncias conhecidas:
|
Substância |
Calor latente de fusão (cal/g) |
|
Água |
79,9 |
|
Cobre |
51 |
|
Alumínio |
95 |
|
Ouro |
15,8 |
|
Zinco |
28,1 |
Quanto maior for o calor latente de fusão de uma substância, mais calor por grama será necessário para fundi-la, levando-a do estado sólido para o estado líquido. O calor latente está intimamente relacionado com o tipo das ligações químicas formadas entre os átomos de uma molécula e, consequentemente, com a quantidade de graus de liberdade que ela apresenta.
Veja também: Conceitos de calor na História
Fluxo de calor
Fluxo de calor, ou fluxo térmico, é uma grandeza que fornece a taxa de passagem de calor através de alguma área. O fluxo de calor é definido no Sistema Internacional de Unidades em Joules por segundo (J/s), e o seu símbolo é geralmente a letra grega Φ.
A fórmula usada para o cálculo do fluxo de calor está representada a seguir:
![]()
Legenda:
Φ – Fluxo de calor (J/s ou cal/s)
k – Condutividade térmica (W/m.K)
A – Área do corpo (m²)
e – Espessura do corpo (m)
Curva de aquecimento
Toda substância pura pode ter a sua curva de aquecimento facilmente determinada. A curva de aquecimento é um gráfico da temperatura da substância em função da quantidade de calor recebida ou fornecida. Durante o aquecimento ou resfriamento da substância, o gráfico toma a forma de uma reta ascendente ou descendente. Nas mudanças de fase, tem a forma de uma reta paralela ao eixo horizontal. Observe:
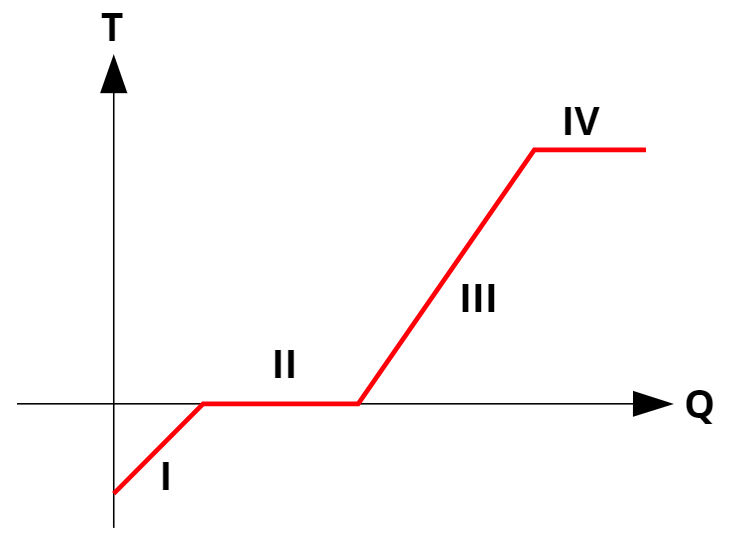
Legenda:
I – Substância no estado sólido sendo aquecida: calor sensível;
II – Substância em processo de fusão: calor latente de fusão;
III – Substância no estado líquido sendo aquecida: calor sensível;
IV – Substância sofrendo evaporação: calor latente de evaporação.
Trocas de calor
Dizemos que, em um sistema fechado, a soma das trocas de calor entre os corpos é nula, isto é, igual a 0. Essa propriedade decorre da conservação da energia: toda a quantidade de calor cedida pelo corpo de maior temperatura é absorvida pelos corpos com menores temperaturas. Dessa forma, podemos escrever a seguinte relação:
![]()
Exercícios resolvidos de Calorimetria
Questão 1 - (PUC-RJ) Uma quantidade de água líquida de massa m = 200 g, a uma temperatura de 30 ºC, é colocada em um calorímetro junto a 150 g de gelo a 0 ºC. Após atingir o equilíbrio, dado que o calor específico da água é c = 1,0 cal/(g . ºC) e o calor latente de fusão do gelo é L = 80 cal/g, calcule a temperatura final nessa situação.
a) 10 °C
b) 15 °C
c) 0 °C
d) 30 °C
e) 60 °C
Resolução:
Considerando a transferência de calor da água para o calorímetro e a do gelo para o calorímetro desprezíveis, toda a quantidade de calor cedido pela massa de água deverá ser absorvida pela massa de gelo. Dessa forma, temos que:
![]()
Além disso, devemos estar atentos à quantidade de calor sensível que a massa de água é capaz de ceder à massa de gelo, bem como à quantidade de calor latente que a massa de gelo requer para ser totalmente fundida. Vamos calcular essas quantidades:
![]()
O resultado acima indica que o gelo necessita de 12.000 cal para ser completamente derretido. Agora calcularemos a quantidade de calor que a água é capaz de ceder.
![]()
Comparando as duas quantidades de calor, percebemos que o gelo requer o dobro da quantidade de calor que pode ser cedida pela água quando ela entrar no equilíbrio térmico com o gelo em 0 ºC. Dessa forma, somente metade da massa de gelo será derretida, cerca de 75 g, e todo o conjunto se encontrará em equilíbrio térmico em 0 ºC.
Questão 2 - Um bloco de determinado material e de massa igual a 1 kg (1000 g), em uma temperatura de 60 °C, é encostado em outro bloco do mesmo material, de massa igual a 600 g e que está em temperatura ambiente, de 20°C. Calcule a temperatura de equilíbrio térmico dos blocos.
Resolução:
Consideramos que toda a energia térmica cedida por um dos blocos é recebida pelo outro, assim:
![]()
Como as duas formas de calor são de calor sensível, teremos a seguinte resolução:

Por Me.Rafael Helerbrock







