O Mecanismo é uma simulação do caminho pelo qual a reação se processa, ele descreve as etapas que os reagentes passam até chegar ao produto final.
Mecanismos foram propostos baseando-se em experimentos, já que não é possível visualizar o passo a passo de uma reação, e são muito úteis em Química Orgânica, uma vez que os compostos orgânicos reagem entre si de várias formas: ruptura das ligações, formação de compostos intermediários.
Existem fatores que interferem no produto final da reação, como, por exemplo, a natureza do solvente, polaridade das ligações, troca de elétrons, etc. Portanto, um determinado mecanismo nem sempre é o único caminho para a formação do produto, eles podem ocorrer de várias formas, ionicamente ou via radicais livres por exemplo.
1. Mecanismo iônico: processo que tem início através da ruptura heterolítica de uma ligação covalente e formação dos íons (carbocátion e carbânion).
Acompanhe o mecanismo de Halogenação de Alcenos.
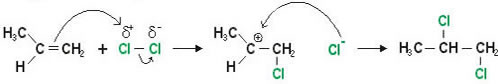
Podemos dividir o mecanismo em etapas:
1ª Etapa: Ruptura heterolítica da ligação covalente (Cl — Cl): formação do carbocátion e do ânion (Cl-).
2ª Etapa: Ataque do cloreto ânion (Cl-) ao carbocátion.
3ª Etapa: Formação do produto 1, 2 - dicloropropano.
Como se vê, a Halogenação de Alcenos ocorre por Mecanismo iônico.
Nota: Como o próprio nome já diz, a Halogenação se dá pela adição de um Halogênio (Cloro) à molécula.
2. Mecanismo via radicais livres: a ruptura homolítica de uma ligação covalente forma radicais livres (muito instáveis e reativos), vejamos um exemplo:
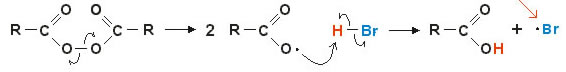
A reação dá início com o rompimento da ligação peroxídica e formação de radical livre. Na etapa intermediária ocorre o ataque do radical ao hidrogênio polarizado do (H — Br) e consequente formação do novo radical livre • Br (altamente instável e reativo).
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Veja mais!
Radicais em Química Orgânica
