O gelo-seco é assim chamado porque apesar de ter a aparência de gelo (água no estado sólido), ele na verdade é o dióxido de carbono sólido (gás carbônico – CO2). E, ao contrário do gelo comum que derrete, ele passa diretamente para o estado gasoso, isto é, sublima.
Essa é a propriedade mais importante do gelo-seco, pois quando ele passa para o estado gasoso, arrasta consigo moléculas de água, originando uma névoa mais densa que o ar. Graças a essa “fumaça branca” formada, o gelo-seco é muito utilizado como um recurso cênico em filmes, shows, teatros, programas de televisão e festas.
Mas, surge a pergunta: o que o gelo-seco tem de diferente das outras substâncias que acarreta na sua sublimação? O que ocorre entre suas moléculas?
O dióxido de carbono é apolar, assim, quando ele está no estado sólido, como gelo-seco, suas moléculas se mantêm nos cristais moleculares graças a uma força de atração intermolecular entre elas, que é a dipolo induzido. Essa força surge quando as suas moléculas se aproximam e ocorre uma repulsão entre seus elétrons, levando a deformações momentâneas nas suas nuvens eletrônicas. Isso significa que surgem dipolos momentâneos nas moléculas, que induzem as moléculas adjacentes, resultando em forças atrativas.
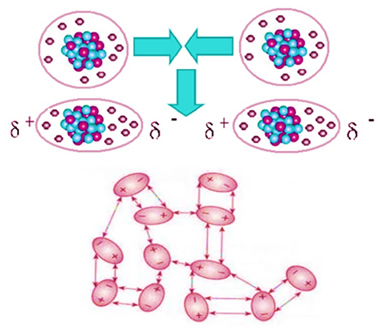
Essa é a única força intermolecular presente nas moléculas apolares do gelo-seco e sua intensidade é muito pequena. A força de dipolo induzido é a mais fraca de todas. Assim, é preciso pouca energia para romper essas forças de atração e fazer com que o composto mude de estado físico. É por isso que o gelo-seco sublima a -78,6ºC, sob pressão de 1 atm.
Outros exemplos de substâncias que também apresentam esse tipo de interação intermolecular e que também sublimam são a naftalina e o iodo sólido.

Por Jennifer Fogaça
Graduada em Quimica
