A oxidação branda em alcenos é uma reação orgânica realizada quando um determinado alceno é colocado em um meio formado por uma base com água e o sal permanganato de potássio (KMnO4), sal esse que é chamado comumente de reagente Bayer.
O produto formado é o chamado diálcool vicinal, isto é, alcoóis que apresentam dois grupos hidroxila (OH-) posicionados em carbonos vizinhos, como na fórmula geral a seguir:
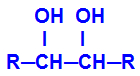
OBS.: R pode ser um radical ou átomos de hidrogênio.
Reagente de Bayer
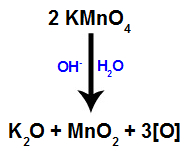
Quando o reagente de Bayer (KMnO4) é misturado com água na presença de base inorgânica (OH-), ele reage e forma óxido de potássio (K2O), dióxido de manganês (MnO2) e oxigênios nascentes (oxigênio livre, representado por ). Veja a equação balanceada do processo.
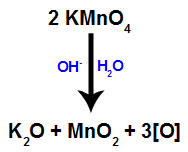
São esses oxigênios nascentes formados a partir do reagente de Bayer que são os responsáveis pela reação de oxidação branda em alcenos (como veremos nos itens a seguir).
Mecanismos em uma reação de oxidação branda em alcenos
-
1º mecanismo: formação dos oxigênios nascentes a partir do reagente de Bayer;
-
2º mecanismo: Ataque dos oxigênios nascentes à ligação dupla presente no alceno, provocando o rompimento da ligação pi e consequente formação de uma valência livre em cada um dos carbonos envolvidos com a ligação pi.
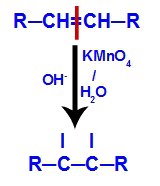
-
3º mecanismo: Os oxigênios nascentes unem-se a hidrônios (H+) formados a partir da autoionização da água, originando grupos hidroxila (OH-).
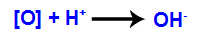
-
4º mecanismo: Ligação das hidroxilas formadas em cada uma das valências livres localizadas nos carbonos onde estava a ligação pi, originando um diálcool vicinal.
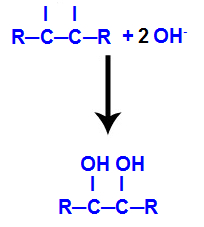
Exemplos de reações de oxidação branda em alcenos
→ Reação de oxidação branda no but-2-eno
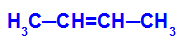
Fórmula estrutural do but-2-eno
Inicialmente a ligação dupla entre os carbonos 2 e 3 do alceno é rompida pelo ataque dos oxigênios nascentes, criando uma valência livre (traço vertical) nos carbonos 2 e 3.
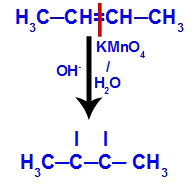
Quebra da ligação pi entre os carbonos 2 e 3 no but-2-eno
Em seguida, o oxigênio nascente une-se a um hidrônio (H+) proveniente da ionização da água, formando grupos hidroxila (OH-), os quais se ligam às valências livres dos carbonos 2 e 3, resultando em um diálcool vicinal.
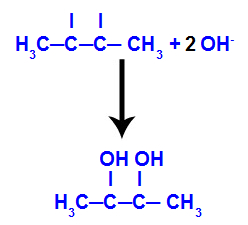
Diálcool vicinal formado a partir do but-2-eno
→ Reação de oxidação branda no 2-metil-propeno
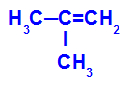
Fórmula estrutural do 2-metil-propeno
Inicialmente a ligação dupla entre os carbonos 1 e 2 do alceno é rompida pelo ataque dos oxigênios nascentes, criando uma valência livre (traço vertical) nos carbonos 1 e 2.
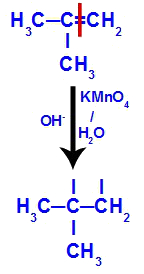
Quebra da ligação pi entre os carbonos 1 e 2 no 2-metil-propeno
Em seguida, o oxigênio nascente une-se a um hidrônio (H+) proveniente da ionização da água, formando grupos hidroxila (OH-), os quais se ligam às valências livres dos carbonos 1 e 2, resultando em um diálcool vicinal.
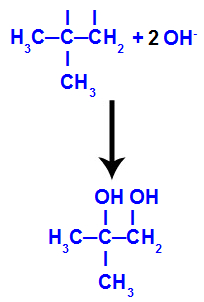
Diálcool vicinal formado a partir do 2-metil-propeno
Por Me. Diogo Lopes Dias
