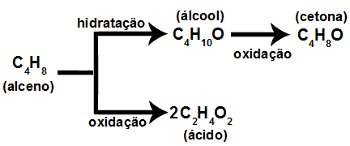
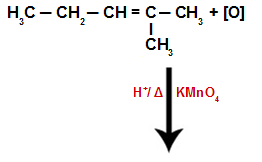
Uma reação de oxidação energética em alcenos ocorre quando há uma ruptura da molécula, ou seja, a quebra simultânea das duas ligações da dupla e a entrada de oxigênio na molécula orgânica.
É possível realizar esse tipo de reação com alcenos ao se utilizar o permanganato de potássio (KMnO4) ou o dicromato de potássio (K2Cr2O7) concentrados, em meio ácido, a quente.
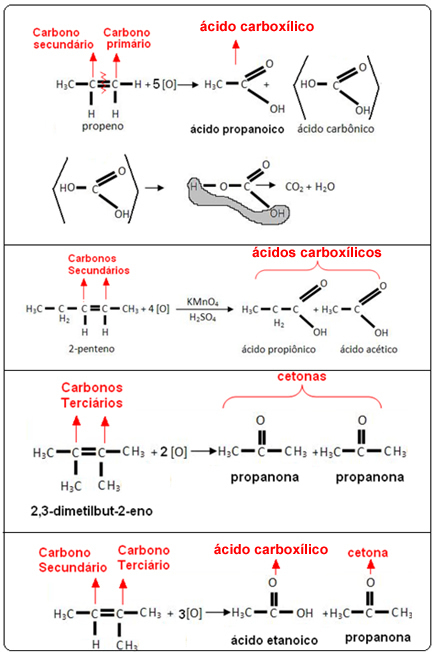
No meio ácido, existem íons H3O+ causando a decomposição do KMnO4 e liberando 5 átomos de oxigênio nascente para cada 2 KMnO4. Observe essa decomposição abaixo:
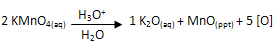
Essa reação é chamada de “energética” por romper as duas ligações da dupla (na oxidação branda só é rompida a ligação pi), outro fator é que essa redução do manganês em meio ácido é bem mais intensa do que em meio básico, como é feita na oxidação branda.
Em seguida, o oxigênio nascente liberado reage com um alceno, mas o produto final depende de quais são os tipos de carbono que estão realizando a ligação dupla, ou seja, se eles são primários, secundários ou terciários. Veja o que ocorre em cada caso:
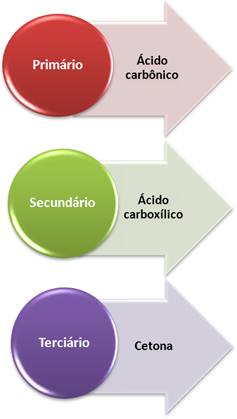
- Carbono primário: Se a insaturação estiver entre dois carbonos primários, os produtos formados serão dois ácidos carbônicos (H2CO3). Se apenas um dos carbonos da dupla ligação for primário, apenas uma das moléculas formadas será um ácido carbônico. No entanto, esse composto é instável e nunca foi isolado, ele se decompõe em água e dióxido de carbono.
- Carbono secundário: Se a insaturação estiver entre dois carbonos secundários, os dois produtos formados serão ácidos carboxílicos. Se apenas um dos carbonos for secundário, ele dará origem a uma molécula de ácido carboxílico, enquanto que a outra dependerá do outro carbono.
- Carbono terciário: Dá origem a cetona.
Veja os exemplos a seguir:
Por Jennifer Fogaça
Graduada em Química