Química Geral no Enem é cobrada de acordo com a Matriz de Referência do Enem e abarca uma das maiores partes dessa matriz. A Química Geral é uma das áreas de maior importância dentro do Enem, uma vez que diversos conceitos são cobrados. Boa parte dos temas de Química Geral são fundamentais para a compreensão de conceitos mais complexos em Química.
A Química Geral costuma ser abordada logo no começo dos estudos de Química dos alunos no ensino médio, trazendo as bases fundamentais da compreensão da matéria e suas transformações. Por isso, é importante que os conceitos ali apresentados estejam bem esclarecidos, de modo que o aluno não se confunda nas questões.
Leia também: Química Geral — detalhes sobre uma das principais áreas da Química
Tópicos deste artigo
- 1 - Resumo sobre Química Geral no Enem
- 2 - O que estudar de Química Geral no Enem?
- 3 - Dicas para estudar Química Geral para o Enem
- 4 - Questões de Química Geral no Enem
Resumo sobre Química Geral no Enem
- Química Geral no Enem é cobrada de acordo com a Matriz de Referência do Enem e abarca uma das maiores partes dessa matriz.
- A Química Geral costuma ser apresentada aos alunos desde o início dos estudos de Química, trazendo conceitos fundamentais para a compreensão da matéria e suas transformações.
- É de extrema necessidade compreender tais conceitos, pois eles se concatenam, ou seja, é preciso entender conceitos-chave e mais simples antes de se aprofundar sobre um tema de Química Geral.
O que estudar de Química Geral no Enem?
Química Geral no Enem é cobrada de acordo com a Matriz de Referência do Enem e abarca uma das maiores partes dessa matriz. Segundo a Matriz de Referência do Enem, disponibilizada pelo Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira (Inep), em seus objetos de conhecimento, a Química Geral pode ser abordada da seguinte forma:
Transformações químicas - Evidências de transformações químicas. Interpretando transformações químicas. Sistemas Gasosos: Lei dos gases. Equação geral dos gases ideais, Princípio de Avogadro, conceito de molécula; massa molar, volume molar dos gases. Teoria cinética dos gases. Misturas gasosas. Modelo corpuscular da matéria. Modelo atômico de Dalton. Natureza elétrica da matéria: Modelo Atômico de Thomson, Rutherford, Rutherford-Bohr. Átomos e sua estrutura. Número atômico, número de massa, isótopos, massa atômica. Elementos químicos e Tabela Periódica. Reações químicas.
Materiais, suas propriedades e usos - Propriedades de materiais. Estados físicos de materiais. Mudanças de estado. Misturas: tipos e métodos de separação. Substâncias químicas: classificação e características gerais. Metais e Ligas metálicas. Ferro, cobre e alumínio. Ligações metálicas. Substâncias iônicas: características e propriedades. Substâncias iônicas do grupo: cloreto, carbonato, nitrato e sulfato. Ligação iônica. Substâncias moleculares: características e propriedades. Substâncias moleculares: H2, O2, N2, Cl2, NH3, H2O, HCl, CH4. Ligação Covalente. Polaridade de moléculas. Forças intermoleculares. Relação entre estruturas, propriedade e aplicação das substâncias.
Água - Ocorrência e importância na vida animal e vegetal. Ligação, estrutura e propriedades. (...) Ácidos, Bases, Sais e Óxidos: definição, classificação, propriedades, formulação e nomenclatura. Conceitos de ácidos e base. Principais propriedades dos ácidos e bases: indicadores, condutibilidade elétrica, reação com metais, reação de neutralização. |1|
Dicas para estudar Química Geral para o Enem
A Química Geral é uma parte da Química em que os estudantes estudam as bases gerais do conhecimento químico. Por isso, há muito foco na estrutura da matéria e também nas suas transformações básicas, sejam elas químicas ou físicas. Majoritariamente, ela costuma ser o ponto de partida dos estudos de Química nas escolas de nosso país. Assim sendo, é bem provável que você tenha visto esses conceitos no 1º ano do ensino médio ou até mesmo no 9º ano do ensino fundamental II.
Mediante isso, os alunos devem entender que ali estão dispostos conceitos-chave, os quais são fundamentais não só para resolver questões de forma específica, mas para se aprofundar em determinados temas. Por exemplo, um aluno só poderá entender interações intermoleculares se ele souber o que é polaridade, mas para saber polaridade, é preciso saber eletronegatividade.
O que se repara, também, é que os temas estão interligados, quase que numa hierarquia. Primeiro, entende-se o átomo e suas estruturas, para depois entender como os átomos se ligam a fim de formar os compostos, depois como esses compostos interagem para formar as substâncias, para então estudar as especificidades de cada substância.
Sendo assim, o estudo da Química Geral para o Enem exige, acima de tudo, a assimilação dos conceitos básicos. É como a construção de uma casa, as etapas devem ser seguidas. Não há como entender e estudar conceitos mais complexos se a base para tal não estiver bem fundamentada. Por isso, não estude ligação iônica, por exemplo, se não souber o que é um íon ou não entender uma distribuição eletrônica ou o conceito de camada de valência.
Veja também: Como os cálculos estequiométricos são cobrados no Enem?
Questões de Química Geral no Enem
Questão 1
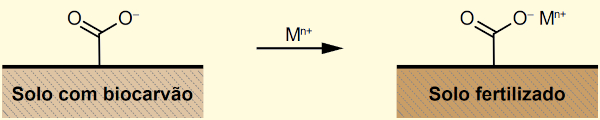
(Enem 2023) Os solos amazônicos, ricos em silicato, não são apropriados para o cultivo por serem incapazes de reter nutrientes. Contudo, descobertas arqueológicas têm demonstrado que os antigos habitantes da Amazônia dominavam a técnica de preparo de um insumo agrícola natural, denominado terra preta. Esse insumo era constituído principalmente de uma espécie de biocarvão (biochar) obtido da queima de matéria orgânica, como troncos de árvores, pedaços de ossos e esterco, capaz de manter um solo fértil por anos.
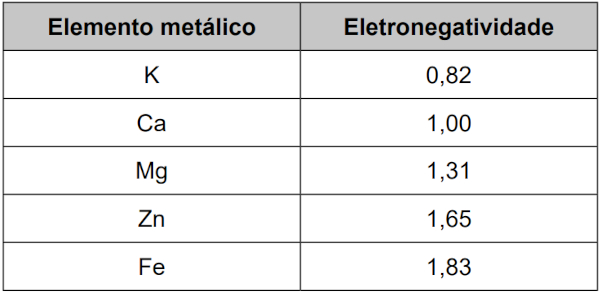
Admite-se que o efeito do biocarvão na fertilização do solo estava, em parte, relacionado à presença de grupos orgânicos do tipo carboxilato em sua superfície, carregados negativamente (─COO−). Esses grupos atraem íons positivos necessários como nutrientes, tais quais os provenientes do potássio (K), do cálcio (Ca) e do magnésio (Mg), além de micronutrientes, como zinco (Zn) e ferro (Fe). Essa ligação no solo fertilizado é predominantemente iônica, conforme ilustra a figura, em que M+ representa os cátions metálicos. De acordo com a escala de Pauling, a eletronegatividade do elemento oxigênio é igual a 3,44.
O quadro apresenta os valores de eletronegatividade desses cinco elementos metálicos.
MICHALOVIC, M. Ancient Soil Chemists of the Amazon. ChemMatters, fev. 2009 (adaptado).
O cátion que resultará em uma interação de maior caráter iônico com o ânion carboxilato será aquele proveniente do elemento
A) potássio.
B) cálcio.
C) magnésio.
D) zinco.
E) ferro.
Resolução:
Alternativa A.
A interação de maior caráter iônico ocorrerá com a maior diferença de eletronegatividade entre o oxigênio e o metal. Como a eletronegatividade do oxigênio é dada como 3,44, a maior interação iônica ocorrerá com o metal de menor eletronegatividade. Dos apresentados, o que atende a esse critério é o potássio, com uma eletronegatividade de 0,82, entregando uma diferença de eletronegatividade igual a 2,62.
Questão 2
(Enem 2023)
O consumo exagerado de refrigerantes é preocupante, pois contribui para o aumento de casos de obesidade e diabetes. Considere dois refrigerantes enlatados, um comum e um diet, e que ambos possuem a mesma quantidade de aditivos, exceto pela presença de açúcar. O refrigerante comum contém basicamente água carbonatada e grande quantidade de açúcar; já o refrigerante diet tem água carbonatada e adoçantes, cujas massas são muito pequenas.
CAVAGIS A D M. PEREIRA E. A. OLIVEIRA, L. C. Um método simples para avaliar o teor de sacarose e CO, em refrigerantes. Química Nova na Escola, n. 3. ago. 2014 (adaptado).
Entre as duas versões apresentadas, o refrigerante comum possui
A) maior densidade.
B) menor viscosidade.
C) maior volume de gás dissolvido.
D) menor massa de solutos dissolvidos.
E) maior temperatura de congelamento.
Resolução:
Alternativa A.
A única diferença entre ambos os refrigerantes, comum e diet, é a presença de açúcar (no comum) e a de adoçantes (no diet). Fora isso, a composição é a mesma. Logo, como os adoçantes têm uma massa menor que a do açúcar, podemos dizer então que o refrigerante comum concentra uma massa maior em um mesmo volume em relação ao refrigerante diet e, por isso, possui maior densidade.
Questão 3
(Enem 2023) Em uma indústria, o controle da dureza da água é importante quando ela é utilizada em caldeiras, uma vez que sais pouco solúveis, formados a partir de sulfatos e carbonatos, podem acumular-se no interior das tubulações, causando obstruções. Para avaliar a água utilizada nessa indústria, foram realizados testes de qualidade que consideraram os seguintes parâmetros:
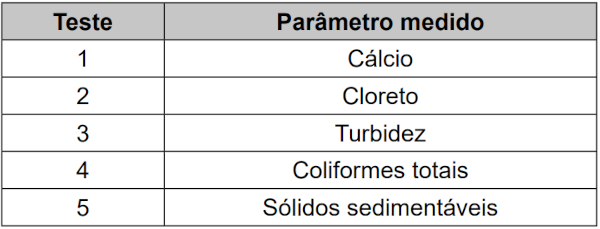
Qual teste deve ser considerado para controlar a formação desse tipo de obstrução de tubulações?
A) 1
B) 2
C) 3
D) 4
E) 5
Resolução:
Alternativa A.
Sais são compostos iônicos formados entre um cátion e um ânion. No caso, os carbonatos e os sulfatos são os ânions e, por isso, o único sal possível a ser formado é com o cálcio (único elemento eletropositivo da tabela).
Além disso, apenas os carbonatos e sulfatos de metais alcalinos e de amônio são solúveis em água. Nos demais elementos a solubilidade é muito baixa, sendo até mesmo considerados insolúveis.
Questão 4
(Enem 2022) A água bruta coletada de mananciais apresenta alto índice de sólidos suspensos, o que a deixa com um aspecto turvo. Para se obter uma água límpida e potável, ela deve passar por um processo de purificação numa estação de tratamento de água. Nesse processo, as principais etapas são, nesta ordem: coagulação, decantação, filtração, desinfecção e fluoretação.
Qual é a etapa de retirada de grande parte desses sólidos?
A) Coagulação.
B) Decantação.
C) Filtração.
D) Desinfecção.
E) Fluoretação.
Resolução:
Alternativa D.
Boa parte dos sólidos em estações de tratamento de água são preparados para serem retirados durante a decantação. Durante a coagulação, as partículas pequenas (coloidais) são aglutinadas em flocos volumosos e densos, os quais deverão sedimentar nos tanques de decantação por ação da gravidade. Contudo, como o processo não apresenta uma eficiência de 100%, a parte dos sólidos remanescentes deve ser retirada na filtração, que consegue reter sólidos mais finos. Caso a filtração fosse utilizada logo de início, o processo seria muito mais demorado, pois os filtros iriam entupir/saturar mais rapidamente.
Questão 5
(Enem Digital 2020)
Entre os materiais mais usados no nosso dia a dia destacam-se os plásticos, constituídos por polímeros. A consequência de seu amplo uso é a geração de resíduos, que necessitam de um destino final adequado em termos ambientais. Uma das alternativas tem sido a reciclagem, que deve respeitar as características dos polímeros que compõem o material. Esse processo envolve algumas etapas, como: separação do resíduo (catação), moagem, hidrólise, lavagem, secagem, pirólise e aquecimento (fusão).
SPINACÉ, M. A. S., PAOLI, M. A. D. Tecnologia de reciclagem de polímeros. Química Nova, n.1, 2005 (adaptado).
Quais das etapas citadas do processo de reciclagem são classificadas como métodos químicos?
A) Hidrólise e pirólise
B) Secagem e pirólise
C) Moagem e lavagem
D) Separação e hidrólise
E) Secagem e aquecimento
Resolução:
Alternativa A.
São considerados métodos químicos aqueles em que há alteração da composição da matéria. Na hidrólise, os reagentes são atacados por moléculas de água, decompondo-se em novas substâncias. Já na pirólise, a decomposição ocorre por ação da energia térmica. Os demais processos citados (secagem, moagem, aquecimento e lavagem) não mudam a composição química das substâncias, apenas o seu aspecto físico e, por isso, não são métodos químicos de reciclagem.
Questão 6
(Enem PPL 2019) Antes da geração do céu, teremos que rever a natureza do fogo, do ar, da água e da terra.
Primeiro, em relação àquilo a que chamamos água, quando congela, parece-nos estar a olhar para algo que se tornou pedra ou terra, mas quando derrete e se dispersa, esta torna-se bafo e ar; o ar, quando é queimado, torna-se fogo; e, inversamente, o fogo, quando se contrai e se extingue, regressa à forma do ar; o ar, novamente concentrado e contraído, torna-se nuvem e nevoeiro, mas, a partir destes estados, se for ainda mais comprimido, torna-se água corrente, e de água torna-se novamente terra e pedras; e deste modo, como nos parece, dão geração uns aos outros de forma cíclica.
PLATÃO, Timeu (c. 360 a.C.).
Buscando compreender a diversidade de formas e substâncias que vemos no mundo, diversas culturas da Antiguidade elaboraram a noção de “quatro elementos” fundamentais, que seriam terra, água, ar e fogo. Essa visão de mundo prevaleceu até o início da Era Moderna, quando foi suplantada diante das descobertas da química e da física.
PLATÃO. Timeu-Crítias. Coimbra: CECh, 2011
Do ponto de vista da ciência moderna, a descrição dos “quatro elementos” feita por Platão corresponde ao conceito de
A) partícula elementar.
B) força fundamental.
C) elemento químico.
D) fase da matéria.
E) lei da natureza.
Resolução:
Alternativa D.
As ideias de Platão acerca dos “quatro elementos” fazem referência direta ao conceito de fase da matéria. Por exemplo, quando em Timeu ele cita as transições entre os elementos (de água para terra, de água para ar, de ar para fogo, etc.), ele faz alusão às transformações que os estados físicos sofrem durante as mudanças de estado. Se uma água (líquido) congela, parece estarmos diante de pedra (sólido). Podemos dizer que há ali uma clara referência ao processo de solidificação, em que não há alteração da composição química da matéria, apenas uma maior aproximação das moléculas por aumento da intensidade das interações intermoleculares. Quando ele cita a dispersão do elemento ao se tornar ar, há também uma grande referência à formação da fase gasosa, em que a matéria se difunde espontaneamente.
Notas
|1| BRASIL. Matriz de Referência Enem. Ministério da Educação, Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira. Disponível em: https://download.inep.gov.br/download/enem/matriz_referencia.pdf.
Fontes
BRASIL. Matriz de Referência Enem. Ministério da Educação, Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira. Disponível em: https://download.inep.gov.br/download/enem/matriz_referencia.pdf.

